Книга: Общая химия
244. Никель (Niccolum).
| <<< Назад 243. Кобальт (Cobaltum). |
Вперед >>> Платиновые металлы 245. Общая характеристика платиновых металлов. |
244. Никель (Niccolum).
Подобно кобальту, никель встречается в природе преимущественно в виде соединений с мышьяком или серой; таковы, например, минералы купферникель NiAs, мышьяковоникелевый блеск NiAsS и др. Никель более распространен, чем кобальт [около 0.01% (масс.) земной коры].
Царская Россия не имела никелевой промышленности и ввозила никель из-за границы. Эта отрасль промышленности была создана у нас только при советской власти. Первый никелевый завод начал работать на Урале в 1934 г.
Металлический никель имеет серебристый цвет с желтоватым оттенком, очень тверд, хорошо полируется, притягивается магнитом. Он характеризуется высокой коррозионной стойкостью — устойчив в атмосфере, в воде, в щелочах и ряде кислот. Активно растворяется никель в азотной кислоте. Химическая стойкость, никеля обусловлена его склонностью к пассивированию — к образованию на поверхности оксидных пленок, обладающих сильным: защитным действием. Главная масса никеля идет на производство различных сплавов с железом, медью, цинком и другими металлами. Присадка никеля к стали повышает ее вязкость и стойкость против коррозии. Сплавы на основе никеля можно разделить на жаропрочные, магнитные и сплавы с особыми свойствами. Жаропрочные сплавы никеля используются в современных турбинах и реактивных двигателях, где температура достигает 850-900°C таких температур сплавы на основе железа не выдерживают. К важнейшим жаропрочным сплавам никеля относятся нимоник, инконель, хастеллой. В состав этих сплавов входит свыше 60% никеля, 15-20% хрома и другие металлы.
Производятся также металлокерамические жаропрочные сплавы, содержащие никель в качестве связующего металла. Эти сплавы выдерживают нагревание до 1100°C. Широко применяются для изготовления элементов электронагревательных устройств сплавы типа нихрома, простейший из которых содержит 80% никеля и 20% хрома.
Из магнитных сплавов никеля особое значение приобрел пермаллой, содержащий 78.5% никеля и 2.5% железа. Он обладает очень высокой начальной магнитной проницаемостью, что обусловливает его намагничиваемость даже в слабых полях. К сплавам никеля с особыми свойствами принадлежат монель-металл, никелин, константан, инвар, платинит. Монель-металл (сплав никеля с 30% меди) широко используется в химическом аппаратостроении, так; как по механическим свойствам он превосходит никель, а по коррозионной стойкости почти не уступает ему. Никелин и константан тоже представляют собой сплавы никеля с медью. Они обладают высоким электрическим сопротивлением, почти не изменяющимся с температурой, и используются в электроизмерительной аппаратуре. Инвар (сплав 36% никеля и 64% железа) практически не расширяется при нагревании до 100°C и применяется в электрорадиотехнике и в химическом машиностроении. Сплав никеля с железом — платинит — имеет коэффициент термического расширения такой же, как у стекла, и используется для впаивания вводов металлических контактов в стекло.
В сравнительно небольших количествах никель расходуется для покрытия им других металлов. Мелко раздробленный никель применяется в качестве катализатора при многих химических процессах. Из чистого никеля изготовляют лабораторную посуду.
Соединения никеля очень сходны с соединениями кобальта. Подобно кобальту, никель образует оксид никеля (II), или закись никеля, NiO и оксид никеля (III), или окись никеля, Ni2O3 и соответствующие им основания; однако известен только один ряд солей никеля, в которых он находится в степени окисленности +2.
Гидроксид никеля (II) Ni(OH)2 выпадает в виде светло-зеленого осадка при действии щелочей на растворы солей никеля. При нагревании он теряет воду и переходит в серо-зеленый оксид никеля (II) NiO.
В отличие от гидроксидов железа (II) и кобальта (II), гидроксид никеля (II) кислородом воздуха не окисляется. В этом проявляется более высокая устойчивость к окислению соединений никеля (II) по сравнению с аналогичными соединениями железа и кобальта.
Соли никеля большей частью имеют зеленый цвет. Из них наиболее применим сульфат никеля NiSO4·7H2O, образующий красивые изумрудно-зеленые кристаллы.
Гидроксид никеля (III) Ni(OH)3 имеет черно-бурый цвет и образуется при действии щелочей на соли никеля в присутствии сильных окислителей.
По свойствам он подобен гидроксиду кобальта (III), но обладает еще более выраженными окислительными свойствами.
Никель (II) образует много комплексных солей.
С оксидом углерода никель дает летучий тетракарбонил никеля Ni(CO)4, разлагающийся при нагревании с выделением никеля. На образовании и термическом разложении тетракарбонила никеля основан один из методов извлечения никеля из руд, а также способ получения высокочистого никеля (см. § 193).
Из соединений никеля важнейшее практическое значение имеет оксид никеля(III), применяемый при изготовлении щелочных кадмиево-никелевых или железо-никелевых аккумуляторов.
Щелочные кадмиево-никелевые и железо-никелевые аккумуляторы. Кадмиево-никелевые (условное обозначение КН) и железо-никелевые (ЖН) аккумуляторы весьма сходны между собой. Основное их различие состоит в материале пластин отрицательного электрода; в аккумуляторах КН они кадмиевые, а в аккумуляторах ЖН — железные. Наиболее широкое применение имеют аккумуляторы КН.
Щелочные аккумуляторы в основном выпускаются с ламельными электродами. В них активные массы заключены в ламели — плоские коробочки с отверстиями. Активная масса положительных пластин заряженного аккумулятора в основном состоит из гидратированного оксида Ni2O3·H2O или NIOOH. Кроме того, в ней содержится графит, добавляемый для увеличения электрической проводимости. Активная масса отрицательных пластин аккумуляторов КН состоит из смеси губчатого кадмия с порошком железа, а аккумуляторов ЖН — из порошка восстановленного железа. Электролитом служит раствор гидроксида калия, содержащий небольшое количество LiOH.
Рассмотрим процессы, протекающие при работе аккумулятора КН. При разряде аккумулятора кадмий окисляется.
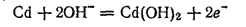
восстанавливается:
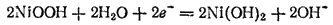
По внешней цепи при этом происходит перенос электронов от кадмиевого электрода к никелевому. Кадмиевый электрод служит анодом и заряжен отрицательно, а никелевый — катодом и заряжен положительно.
Суммарную реакцию, протекающую в аккумуляторе КН при его работе, можно выразить уравнением, которое получится при сложении двух последних электрохимических уравнений:
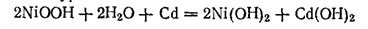
Э.д.с. заряженного кадмиево-никелевого аккумулятора равна приблизительно 1,4 В. По мере работы (разряда) аккумулятора напряжение на его зажимах падает. Когда оно становится ниже 1 В, аккумулятор заряжают.
При зарядке аккумулятора электрохимические процессы на его электродах «обращаются». На кадмиевом электроде происходит восстановление металла
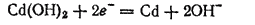
на никелевом — окисление гидроксида никеля(II):
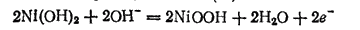
Суммарная реакция при зарядке обратна реакции, протекающей при разряде:
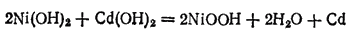
- 676 -
| <<< Назад 243. Кобальт (Cobaltum). |
Вперед >>> Платиновые металлы 245. Общая характеристика платиновых металлов. |
- 233. Общая характеристика благородных газов.
- 234. Гелий (Helium).
- 235. Неон. Аргон.
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- 236. Железо (Ferrum).
- 237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
- 238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
- 239. Производство чугуна и стали.
- 240. Термическая обработка стали.
- 241. Сплавы железа.
- 242. Химические свойства железа. Соединения железа.
- 243. Кобальт (Cobaltum).
- 244. Никель (Niccolum).
- Платиновые металлы 245. Общая характеристика платиновых металлов.
- 246. Платина (Platinum).
- 247. Палладий (Palladium). Иридий (Iridium).
- Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 235. Неон. Аргон.
- Платиновые металлы 245. Общая характеристика платиновых металлов.
- 243. Кобальт (Cobaltum).
- 236. Железо (Ferrum).
- 246. Платина (Platinum).
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- 247. Палладий (Palladium). Иридий (Iridium).
- 234. Гелий (Helium).
- 10.16. ПЛАТИНОВЫЕ МОНЕТЫ РОССИИ
