Книга: Общая химия
243. Кобальт (Cobaltum).
| <<< Назад 242. Химические свойства железа. Соединения железа. |
Вперед >>> 244. Никель (Niccolum). |
243. Кобальт (Cobaltum).
В природе кобальт мало распространен: содержание его в земной коре составляет около 0,004; (масс.). Чаще всего кобальт встречается в соединении с мышьяком в виде минералов кобальтовый шпейс CoAs2 и кобальтовый блеск CaAs.
Кобальт — твердый, тягучий, похожий на железо блестящий металл. Как и железо, он обладает магнитными свойствами. Вода и воздух на него не действуют. В разбавленных кислотах кобальт растворяется значительно труднее, чем железо.
Кобальт применяется главным образом в сплавах, которые используются в качестве жаропрочных и жаростойких материалов, для изготовления постоянных магнитов и режущих инструментов. Жаропрочный и жаростойкий сплав виталлиум содержит 60% Co, 28% Cr, 3% W и 4% Mo. Этот сплав сохраняет высокую прочность и не поддается коррозии при температурах до 800-850°C. Твердые сплавы стеллиты, содержащие 40-60% Co, 20-35% Cr, 5-20% W и 1-2% C, применяются для изготовления режущего инструмента. Кобальт входит также в состав керамикометаллических твердых сплавов — керметов (см. стр. 639). Соединения кобальта придают стеклу темно-синюю окраску (вследствие образования силиката кобальта). Такое стекло, истолченное в порошок, употребляется под названием «шмальты» или «кобальта» в качестве синей краски. Радиоактивный изотоп 60Co применяется в медицине как источник ?-излучения («кобальтовая пушка»).
Кобальт образует оксид кобальта(II), или закись кобальта, CoO и оксид кобальта (III), или окись кобальта, Co2O3 , которым соответствуют гидроксиды Co(OH)2 и Co(OH)3. Этим соединениям отвечают два ряда солей, но соли кобальта(III) нестойки и легко переходят в соли кобальта(II). Известен также смешанный оксид Co3O4 (или CoO·Co2O3).
Соли кобальта(II) в безводном состоянии обычно синего цвета, а их водные растворы и кристаллогидраты имеют розовый цвет; например, хлорид кобальта (II) образует розовые кристаллы состава CoCl2·6H2O. Фильтровальная бумага, пропитанная раствором этой соли и потом высушенная, может служить грубым гигроскопом (указателем влажности), так как в зависимости от содержания влаги в воздухе принимает разные оттенки цветов — от синего до розового.
Гидроксид кобальта(II) Co(OH)2 получается при действии щелочи на растворы солей кобальта(II). Вначале выпадает осадок синей основной соли, который при кипячении жидкости переходит в розовый гидроксид Co(OH)2; последний при прокаливании дает оксид кобальта (II) CoO серо-зеленого цвета.
Соединения кобальта (II) окисляются с большим трудом, чем соединения железа(II) так, гидроксид кобальта(II) окисляется на воздухе в темно-бурый гидроксид кобальта (III) Co(OH)3 гораздо медленнее, чем происходит аналогичное превращение гидроксидов железа.
- 673 -
Однако в присутствии сильных окислителей, например гипохлорита натрия, окисление Co(OH)2 в Co(OH)3 протекает быстро:
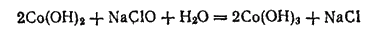
При действии на гидроксид кобальта (III) кислородсодержащих кислот соли кобальта (III) не образуются, а выделяется кислород и получаются соли кобальта (II), например:
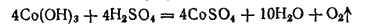
Из соляной кислоты гидроксид кобальта (III) выделяет хлор:
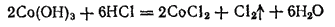
Таким образом, соединения Co(III) менее устойчивы, чем соединения железа(III), и проявляют более сильно выраженную окислительную способность.
Для кобальта (III) очень характерна его способность к комплексообразованию. Комплексные соединения кобальта (II) хотя и известны, но очень неустойчивы. В комплексных солях кобальт может входить как в состав катиона, так и в состав аниона, например [Co(NH3)6]Cl3 и K3[Co(NO2)6]. Координационное число кобальта равно шести.
| <<< Назад 242. Химические свойства железа. Соединения железа. |
Вперед >>> 244. Никель (Niccolum). |
- 233. Общая характеристика благородных газов.
- 234. Гелий (Helium).
- 235. Неон. Аргон.
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- 236. Железо (Ferrum).
- 237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
- 238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
- 239. Производство чугуна и стали.
- 240. Термическая обработка стали.
- 241. Сплавы железа.
- 242. Химические свойства железа. Соединения железа.
- 243. Кобальт (Cobaltum).
- 244. Никель (Niccolum).
- Платиновые металлы 245. Общая характеристика платиновых металлов.
- 246. Платина (Platinum).
- 247. Палладий (Palladium). Иридий (Iridium).
