Книга: Общая химия
233. Общая характеристика благородных газов.
| <<< Назад Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ |
Вперед >>> 234. Гелий (Helium). |
233. Общая характеристика благородных газов.
Главную подгруппу восьмой группы периодической системы составляют благородные газы — гелий, неон, аргон, криптон, ксенон и радон. Эти элементы характеризуются очень низкой химической активностью, что и дало основание назвать их благородными, или инертными, газами. Они лишь с трудом образуют соединения с другими элементами или веществами; химические соединения гелия, неона и аргона не получены. Атомы благородных газов не соединены в молекулы, иначе говоря, их молекулы одноатомны.
Благородные газы заканчивают собой каждый период системы элементов. Кроме гелия, все они имеют в наружном электронном слое атома восемь электронов, образующих очень устойчивую систему. Также устойчива и электронная оболочка гелия, состоящая из двух электронов. Поэтому атомы благородных газов характеризуются высокими значениями энергии ионизации и, как правило, отрицательными значениями энергии сродства к электрону.
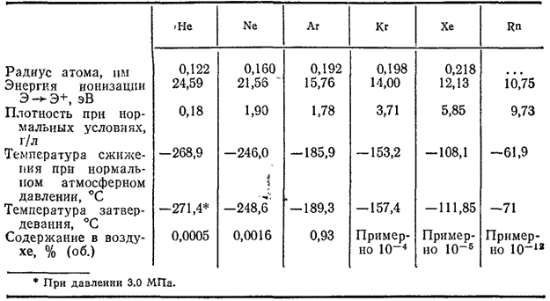
В табл. 38 приведены некоторые свойства благородных газов, а также их содержание в воздухе. Видно, что температуры сжижения и затвердевания благородных газов тем ниже, чем меньше их атомные массы или порядковые номера: самая низкая температура сжижения у гелия, самая высокая — у радона.
- 647 -
Таблица 38. Некоторые свойства благородных газов и их содержание в воздухе
До конца XIX века полагали, что воздух состоит только из кислорода и азота. Но в 1894 г. английский физик Дж. Рэлей установил, что плотность азота, полученного из воздуха (1,2572 г/л ), несколько больше, чем плотность азота, полученного из его соединений (1,2505 г/л ). Профессор химии У. Рамзай предположил, что разница в плотности вызвана присутствием в атмосферном азоте примеси какого-то более тяжелого газа. Связывая азот с раскаленным магнием (Рамзай) или вызывая действием электрического разряда его соединение с кислородом (Рэлей), оба ученых выделили из атмосферного азота небольшие количества химически инертного газа. Так был открыт неизвестный до того времени элемент, названный аргоном. Вслед за аргоном были выделены гелий, неон, криптон и ксенон, содержащиеся в воздухе в ничтожных количествах. Последний элемент подгруппы — радон — был открыт при изучении радиоактивных превращений.
Следует отметить, что существование благородных газов было предсказано еще в 1883 г., т. е. за 11 лет до открытия аргона, русским ученым II А. Морозовым (1854—1946), который за участие в революционном движении был в 1882 г. заключен царским правительством в Шлиссельбургскую крепость. Н. А. Морозов правильно определил место благородных газов в периодической системе, выдвинул представления о сложном строении атома, о возможности синтеза элементов и использования внутриатомной энергии. Из заключения Н. А. Морозов был освобожден в 1905 г., и его замечательные предвидения стали известны только в 1907 г. после издания его книги «Периодические системы строения вещества», написанной в одиночном заключении.
В 1926 г. Н. А. Морозов был избран почетным членом Академии наук СССР.
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. Были известны лишь сравнительно нестойкие молекулярные соединения благородных газов — например, гидраты Ar·6H2O, Kr·6H2O, Xe·6H2O, образующиеся при действии сжатых благородных газов на кристаллизующуюся переохлажденную воду. Эти гидраты принадлежат к типу клатратов (см. § 72); валентные связи при образовании подобных соединений не возникают.
- 648 -
Образованию клатратов с водой благоприятствует наличие в кристаллической структуре льда многочисленных полостей (см. § 70).
Однако в течение последних десятилетий было установлено, что криптон, ксенон и радон способны вступать в соединение с другими элементами и прежде всего с фтором. Так, прямым взаимодействием благородных газов с фтором (при нагревании или в электрическом разряде) получены фториды KrF2, XeF2, KrF4, XeF4 и RnF4. Все они представляют собой кристаллы, устойчивые при обычных условиях. Получены также производные ксенона в степени окисленности +6 — гексафторид XeF6, триоксид XeO3, гидроксид Xe(OH)6. Последние два соединения проявляют кислотные свойства; так, реагируя со щелочами, они образуют соли ксеноновой кислоты, например: XeO3 + Ba(OH)2 = BaXeO4 + H2O.
Производные ксенона (VI) -сильные окислители. Однако при действии на них еще более сильных окислителей можно получить соединения, в которых ксенон имеет степень окисленности +8. Из подобных соединений известны октафторид XeF8, тетраоксид XeO4 и оксогексафторид XeOF6.
Более высокая химическая активность криптона, ксенона и радона по сравнению с первыми членами группы благородных газов объясняется относительно низкими потенциалами ионизации их атомов (см. табл. 38). Для криптона, ксенона и радона эти величины близки к потенциалам ионизации некоторых других элементов (например, потенциал ионизации атома азота равен 14,53 В, атома хлора —12,97 В).
Наибольшее практическое применение находят аргон, неон и гелий.
| <<< Назад Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ |
Вперед >>> 234. Гелий (Helium). |
- 233. Общая характеристика благородных газов.
- 234. Гелий (Helium).
- 235. Неон. Аргон.
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- 236. Железо (Ferrum).
- 237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
- 238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
- 239. Производство чугуна и стали.
- 240. Термическая обработка стали.
- 241. Сплавы железа.
- 242. Химические свойства железа. Соединения железа.
- 243. Кобальт (Cobaltum).
- 244. Никель (Niccolum).
- Платиновые металлы 245. Общая характеристика платиновых металлов.
- 246. Платина (Platinum).
- 247. Палладий (Palladium). Иридий (Iridium).
- 4.6.4. Сравнительная характеристика представителей типа Плоские черви
- 1. Общая характеристика и возбудители ПТИ
- 1. Общая характеристика инфекции
- 1. Характеристика группы
- 12. Общая характеристика формы и периоды инфекции
- 28. Общая характеристика и классификация семейства энтеробактерий
- 1. Характеристика семейства энтеробактерий
- Общая характеристика экваториального климата
- 4.6.3. Тип Кишечнополостные. Общая характеристика. Многообразие кишечнополостных
- 4.4.1. Общая характеристика царства Растения
- 4.7.6.Класс Млекопитающие. Общая характеристика
- 2.2. Клетка – единица строения, жизнедеятельности, роста и развития организмов. Многообразие клеток. Сравнительная харак...
