Книга: Общая химия
207. Диссоциация комплексных соединений в растворах.
| <<< Назад 206. Природа химической связи в комплексных соединениях. |
Вперед >>> 208. Влияние координации на свойства лигандов и центрального атома. |
207. Диссоциация комплексных соединений в растворах.
Мы уже говорили о том, что внутренняя и внешняя сфера комплексного соединения сильно различаются по устойчивости; частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе.
Эта диссоциация называется первичной, она протекает почти нацело, по типу диссоциации сильных электролитов. Лиганды, находящиеся во внутренней сфере, связаны с центральным атомом значительно прочнее и отщепляются лишь в небольшой степени. Обратимый распад внутренней сферы комплексного соединения носит название вторичной диссоциации. Например, диссоциацию комплекса [Ag(NH3)2]Cl можно записать так:
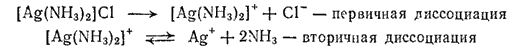
Вторичная диссоциация характеризуется наличием равновесия между комплексной частицей, центральным ионом и лигандами. В этом можно убедиться на основании следующих реакций. Если на раствор, содержащий комплексный ион [Ag(NH3)2]+, подействовать раствором какого-нибудь хлорида, то осадка не образуется, хотя из растворов обычных солей серебра при добавлении хлоридов выделяется осадок хлорида серебра.
- 582 -
Очевидно, концентрация ионов серебра в аммиачном растворе слишком мала, чтобы при введении в него даже избытка хлорид-ионов можно было бы достигнуть значения произведения растворимости хлорида серебра (ПРAgCl=1.8·10-10). Однако после прибавления к раствору комплекса иодида калия выпадает осадок иодида серебра. Это доказывает, что ионы серебра все же имеются в растворе. Как ни мала их концентрация, но она оказывается достаточной для образования осадка, так как произведение растворимости иодида серебра AGI составляет только 1·10-16, т. е. значительно меньше, чем у хлорида серебра. Точно так же при действии сероводорода получается осадок сульфида серебра Ag2S, произведение растворимости которого равно 10-51.
Уравнение протекающих реакций можно записать так:
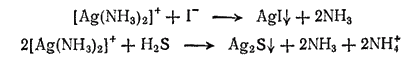
Диссоциация ионов [Ag(NH3)2]+, согласно приведенному выше уравнению, как и диссоциация всякого слабого электролита, подчиняется закону действия масс и может быть охарактеризована соответствующей константой равновесия, называемой константой нестойкости комплексного иона:
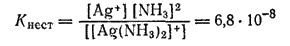
Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса. Константы нестойкости, в выражения которых входят концентрации ионов и молекул, называются «концентрационными». Более строгими и не зависящими от концентраций и ионной силы раствора являются константы нестойкости, содержащие вместо концентраций активности ионов и молекул. В разбавленных растворах эти два различных выражения констант нестойкости совпадают друг с другом,
Из приведенной формулы видно, что чем меньше концентрация продуктов распада, т. е. чем устойчивее комплекс, тем меньше его константа нестойкости. Наиболее устойчивые в растворах комплексные частицы имеют наименьшие константы нестойкости. Так, среди однотипных соединений
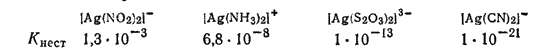
устойчивость комплекса возрастает при переходе от [Ag(NO2)2]- к [Ag(CN)2]-. Ион [Ag(CN)2]- настолько стоек, что даже прибавление иодида калия к раствору комплексной соли не приводит к образованию осадка иодида серебра. Но при действии сероводорода, ввиду ничтожно малого значения произведения растворимости сульфида серебра, все же выпадает осадок сульфида серебра.
- 583 -
В последнее время для характеристики устойчивости комплексных соединений предпочитают пользоваться величиной, обратной константе нестойкости, называемой константой устойчивости. Для иона [Ag(NH3)2]+ константа устойчивости равна:
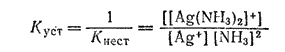
До сих пор шла речь об общих константах нестойкости и устойчивости, относящихся к распаду комплекса на конечные продукты. В действительности же в растворах имеет место ступенчатая диссоциация комплекса, аналогично ступенчатой диссоциации слабых электролитов, например многоосновных кислот.
Так, в водном растворе K2[PtCl4] присутствуют в различных соотношениях все комплексы, участвующие в равновесиях:

Каждое из этих равновесий характеризуется своей ступенчатой константой нестойкости K4, K3 и т. д. По мере отщепления хлорид-ионов заряд комплекса становится все более положительным, а число ионов Cl- в комплексе уменьшается. В результате последовательный отрыв хлорид-ионов все в большей степени затрудняется. Поэтому между ступенчатыми константами нестойкости иона [PtCl4]2- имеет место соотношение: K4>K3>K2>K1.
Такое изменение в значениях последовательных констант нестойкости носит общий характер*. Значение общей константы нестойкости равно произведению всех ступенчатых констант.
Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, с меньшей константой нестойкости. Например, для иона [Ag(NH3)2]+ Kнест = 6,8·10-8, а для иона NH4+ Kнест = 5,4·10-1 поэтому под действием кислот аммиакат серебра разрушается с образованием ионов Ag+ и NH4+:

- 584 -
Комплекс же [Pt(NH3)4]2+ (Kнест = 5·10-34) не разрушается при комнатной температуре даже в концентрированной соляной кислоте.
Процессы комплексообразования широко используются в аналитической химии. При выборе условий наиболее эффективного разделения ионов исходят из соотношения констант устойчивости образуемых ими комплексных соединений.
Например, катионы Ni2+, Co2+, Zn2+ дают устойчивые растворимые аммиакаты, а Al3+, Fe3+, Cr3+ менее склонны к комплексообразованию с аммиаком и осаждаются при действии аммиака в виде гидроксидов. Это позволяет разделить действием аммиака эти две группы катионов. Подобного рода соображения могут быть использованы для разделения анионов: так, можно осадить смесь хлоридов и иодидов в виде AgCl и AgI и далее обработать ее аммиаком — в раствор перейдет только AgCl, а AgI останется в осадке. Для того чтобы растворить AgI, нужно применить лиганд, связывающий Ag+ значительно прочнее, например CN-, так как для комплекса [Ag(CN)2]- Kнест = 1·10-21. В растворе KCN иодид серебра растворяется с образованием K[Ag(CN)2]:

Константы устойчивости однотипных комплексов зависят от ряда факторов, и прежде всего от природы центрального атома и лигандов. В комплексах с центральными ионами, обладающими слабой поляризующей способностью, например с ионами щелочных и щелочноземельных металлов, устойчивость растет по мере увеличения интенсивности электростатического взаимодействия между центральным ионом и лигандами: чем больше заряды центрального иона и лигандов и чем меньше их радиусы, тем выше устойчивость комплексов. Эти катионы образуют более устойчивые комплексы с лигандами, содержащими элементы малых периодов (кислород, азот) и с ионами F-.
Для другой большой группы комплексообразователей — катионов платиновых металлов, ионов Hg2+, Ag+, Au3+, у которых поляризующая способность выражена сильно и характер связи центрального атома с лигандами приближается к ковалентному, — наиболее устойчивы комплексы с легко поляризующимися лигандами. К последним относятся, например, ионы I- и лиганды, содержащие атомы Р и S.
| <<< Назад 206. Природа химической связи в комплексных соединениях. |
Вперед >>> 208. Влияние координации на свойства лигандов и центрального атома. |
- 203. Основные положения координационной теории.
- 204. Основные типы и номенклатура комплексных соединений.
- 205. Пространственное строение и изомерия комплексных соединений.
- 206. Природа химической связи в комплексных соединениях.
- 207. Диссоциация комплексных соединений в растворах.
- 208. Влияние координации на свойства лигандов и центрального атома.
- Диссоциация и трансформация
- 163. Классификация органических соединений.
- 205. Пространственное строение и изомерия комплексных соединений.
- 162. Теория химического строения органических соединений.
- 161. Отличительные особенности органических соединений.
- 160. Общая характеристика органических соединений.
- 90. Диссоциация воды. Водородный показатель.
- 206. Природа химической связи в комплексных соединениях.
- 204. Основные типы и номенклатура комплексных соединений.
- Коротко о применении лантана и его соединений
- Проблема № 2: дальнейшее изучение химии рутения и его соединений
