Книга: Общая химия
79. Давление пара растворов.
| <<< Назад 78. Осмос. |
Вперед >>> 80. Замерзание и кипение растворов. |
79. Давление пара растворов.
При данной температуре давление насыщенного пара над каждой жидкостью — величина постоянная. Опыт показывает, что при растворении в жидкости какого-либо вещества давление насыщенного пара этой жидкости понижается. Таким образом, давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре. Разность между этими величинами принято называть понижением давления пара над раствором (или понижением давления пара раствора). Отношение величины этого понижения к давлению насыщенного пара над чистым растворителем называется относительным понижением давления пара над раствором.
Обозначим давление насыщенного пара растворителя над чистым растворителем через p0 , а над раствором через p. Тогда относительное понижение давления пара над раствором будет представлять собою дробь:
(p0 - p)/p0
В 1887 г. французский физик Рауль, изучая растворы различных нелетучих жидкостей и веществ в твердом состоянии, установил закон, связывающий понижение давления пара над разбавленными растворами неэлектролитов с концентрацией:
Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества.
Математическим выражением закона Рауля является уравнение:
(p0 - p)/p0 = N2
Здесь N2 — молярная доля растворенного вещества.
Явление понижения давления насыщенного пара над раствором вытекает из принципа Ле Шателье. Представим себе равновесие между жидкостью, например, водой, и ее паром.
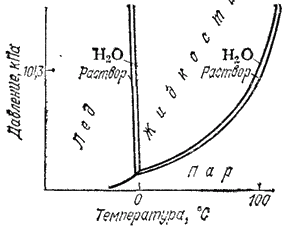
Рис. 78. Диаграмма состояния воды и водного раствора нелетучего вещества.
Это равновесие, которому отвечает определенное давление насыщенного пара, можно выразить уравнением
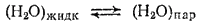
Если теперь растворить в воде некоторое количество какого-либо вещества, то концентрация молекул воды в жидкости понизится и пойдет процесс, увеличивающий ее, — конденсация пара. Новое равновесие установится при более низком давлении насыщенного пара.
Понижение давления пара над раствором находит отражение на диаграмме состояния. На рис. 78 приведена схема диаграммы состояния воды и водного раствора нелетучего вещества. Согласно закону Рауля, давление водяного пара над водным раствором ниже, чем над водой. Поэтому кривая кипения для раствора лежит ниже, чем для воды. При переходе от воды к раствору изменяется также положение кривой плавления. И кривая кипения, и кривая плавления раствора расположены тем дальше от соответствующих кривых воды, чем концентрированнее раствор.
| <<< Назад 78. Осмос. |
Вперед >>> 80. Замерзание и кипение растворов. |
- 69. Вода в природе.
- 70. Физические свойства воды.
- 71. Диаграмма состояния воды.
- 72. Химические свойства воды.
- 73. Характеристика растворов. Процесс растворения.
- 74. Способы выражения состава растворов.
- 75. Гидраты и кристаллогидраты.
- 76. Растворимость.
- 77. Пересыщенные растворы.
- 78. Осмос.
- 79. Давление пара растворов.
- 80. Замерзание и кипение растворов.
- 80. Замерзание и кипение растворов.
- § 35. Давление атмосферы
- Подавление устойчивости
- Гидростатическое давление как в морских глубинах
- Социальное давление
- 229. Каково давление на дне океана?
- 228. На сколько увеличивается давление с глубиной?
- 411. Какое минимальное давление воздуха было зарегистрировано в урагане или тайфуне?
- § 18. Вес воздуха и атмосферное давление
- 692. Почему глубоководные рыбы способны выдерживать огромное давление?
- 604. Какое давление способны выдержать млекопитающие?
- 25. Причина приливов не притяжение Луны, а давление нагреваемой Солнцем атмосферы
