Книга: Общая химия
78. Осмос.
| <<< Назад 77. Пересыщенные растворы. |
Вперед >>> 79. Давление пара растворов. |
78. Осмос.
Как уже говорилось, раствор представляет собой гомогенную систему. Частицы растворенного вещества и растворителя находятся в беспорядочном тепловом движении и равномерно распределяются по всему объему раствора.
- 216 -
Если поместить в цилиндр концентрированный раствор какого-либо вещества, например, сахара, а поверх него осторожно налить слой более разбавленного раствора сахара, то вначале сахар и вода будут распределены в объеме раствора неравномерно. Однако через некоторое время молекулы сахара и воды вновь равномерно распределятся по всему объему жидкости. Это происходит потому, что молекулы сахара, беспорядочно двигаясь, проникают как из концентрированного раствора в разбавленный, так и в обратном направлении; но при этом в течение любого промежутка времени из более концентрированного раствора в менее концентрированный переходит больше молекул сахара, чем из разбавленного раствора в концентрированный. Точно так же молекулы воды движутся в различных направлениях, но при этом из разбавленного раствора, более богатого водой, в концентрированный раствор переходит больше молекул воды, чем за то же время переносится в обратном направлении. Таким образом возникает направленное перемещение сахара из концентрированного раствора в разбавленный, а воды — из разбавленного раствора в концентрированный; каждое вещество переносится при этом, туда, где его концентрация меньше. Такой самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентрации, называется диффузией.
В ходе диффузии некоторая первоначальная упорядоченность в распределении веществ (высокая концентрация вещества в одной части системы и низкая — в другой) сменяется полной беспорядочностью их распределения. При этом энтропия системы возрастает. Когда концентрация раствора во всем его объеме выравнивается, энтропия достигает максимума и диффузия прекратится.
Диффузию можно наблюдать, если налить в стеклянный цилиндр какой-либо окрашенный раствор, например, раствор KMnO4, а сверху него осторожно, чтобы не вызвать перемешивания, добавить воды. Вначале будет заметна резкая граница, но постепенно она будет размываться; через некоторое время растворенное вещество равномерно распределится по всему объему раствора и вся жидкость примет один и тот же цвет.
В рассмотренном примере частицы растворителя и растворенного вещества диффундируют в противоположных направлениях. Такой случай называется встречной или двусторонней диффузией. Иначе будет обстоять дело, если между двумя растворами поместить перегородку, через которую растворитель может проходить, а растворенное вещество — не может. Такие перегородки, получившие название полупроницаемых, существуют в природе, а также могут быть получены искусственно. Например, если пропитать глиняный пористый цилиндр раствором медного купороса, а затем погрузить его в раствор гексацианоферрата (II) калия (K4[Fe(CN)6]) , то в порах цилиндра осядет гексацианоферрат (II) меди.
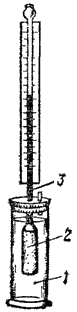
Рис. 77. Схема прибера для измерения осмотического давления: 1 — сосуд с содой; 2 — сосуд с полупроницаемыми стенками; 3 — трубка.
Обработанный таким образом цилиндр обладает свойствами полупроницаемой перегородки; через его стенки могут проходить молекулы воды, но для молекул растворенного вещества они непроницаемы.
Если в такой цилиндр налить раствор какого-либо вещества, например, сахара, и погрузить цилиндр в воду, то выравнивание концентраций будет происходить только вследствие перемещения молекул воды. Последние в большем числе диффундируют в раствор, чем обратно, поэтому объем раствора будет постепенно увеличиваться, а концентрация сахара в нем уменьшаться. Такая односторонняя диффузия через полупроницаемую перегородку называется осмосом.
Возьмем сосуд 2 с полупроницаемыми стенками, переходящий вверху в узкую вертикальную трубку 3 (рис. 77). Наполним его раствором сахара и погрузим в сосуд 1 с водой. Вследствие осмоса объем раствора будет постепенно увеличиваться и раствор начнет заполнять вертикальную трубку. По мере поднятия уровня раствора в трубке будет создаваться избыточное давление водяного столба (гидростатическое давление), измеряемое разностью уровней жидкости и противодействующее проникновению молекул воды в раствор. Когда гидростатическое давление достигнет определенной величины, осмос прекратится — наступит равновесие. Гидростатическое давление станет равным тому давлению, которое служит количественной характеристикой осмоса, — осмотическому давлению раствора. Измеряя гидростатическое давление при таком равновесии, можно тем самым определить величину осмотического давления.
Явления осмоса играют очень важную роль в жизни животных и растительных организмов. Оболочки клеток представляют собой перепонки, легко проницаемые для воды, но почти непроницаемые для веществ, растворенных во внутриклеточной жидкости. Проникая в клетки, вода создает в них избыточное давление, которое слегка растягивает оболочки клеток и поддерживает их в напряженном состоянии. Вот почему такие мягкие органы растения, как травянистые стебли, листья, лепестки цветов, обладают упругостью. Если срезать растение, то вследствие испарения воды объем внутриклеточной жидкости уменьшается, оболочки клеток опадают, становятся дряблыми — растение вянет.
- 218 -
Но стоит только начавшее вянуть растение поставить в воду, как начинается осмос, оболочки клеток снова напрягаются и растение принимает прежний вид.
Осмос является также одной из причин, обусловливающих поднятие воды по стеблю растения, питание клеток и многие другие явления.
При измерениях осмотического давления различных растворов было установлено, что величина осмотического давления зависит от концентрации раствора и от его температуры, но не зависит ни от природы растворенного вещества, ни от природы растворителя. В 1886 г. Вант-Гофф показал, что для растворов неэлектролитов невысоких концентраций зависимость осмотического давления от концентрации и температуры раствора выражается уравнением (закон Вант-Гоффа):
P = CRT
Здесь Р — осмотическое давление раствора, кПа; С — его молярная концентрация (молярность), моль/л; R — универсальная газовая постоянная, 8,314 Дж/(моль·К); Т — абсолютная температура раствора.
Молярность раствора С представляет собой отношение количества растворенного вещества n к объему раствора V (л)
C = n/V
а количество вещества равно его массе m, деленной на молярную массу М. Отсюда для молярности раствора получаем:
C = m/MV
Подставляя это значение С в уравнение Вант-Гоффа, найдем:
PV = mRT/M
Полученное уравнение по форме напоминает уравнение состояния идеального газа Клапейрона — Менделеева. Это уравнение позволяет по величине осмотического давления раствора определять молярную массу (а значит, и относительную молекулярную массу) растворенного вещества.
Пример. Осмотическое давление раствора, в 250 мл которого содержится 3 г. сахара, при 12°C равно 83,14 кПа. Определить относительную молекулярную массу сахара.
Подставляя данные в последнее уравнение, получаем
83,14·0,25 = 3·8,314(273+12)/M
откуда М=342 г/моль. Относительная молекулярная масса сахара равна 342.
- 219 -
Если к раствору, отделенному от воды полупроницаемой перегородкой, приложить внешнее давление, равное осмотическому давлению раствора, то, как уже говорилось, осмос прекратится.
Если же приложенное внешнее давление превысит осмотическое, то диффузия воды будет преимущественно происходить из раствора в водную фазу, т. е. в направлении, противоположном направлению переноса воды при осмосе. Такое явление получило название обратного осмоса.
В настоящее время обратный осмос начали применять как одни из наиболее экономичных способов опреснения воды. Солевом раствор (например, морскую воду) отделяют полупроницаемой мембраной от пресной воды и подвергают давлению более высокому, чем осмотическое давление раствора. В результате часть содержащейся в растворе воды «вытесняется» в фазу пресной воды, а концентрация солей в оставшемся растворе повышается. Концентрированный солевой раствор периодически заменяют свежими порциями подлежащей опреснению воды.
| <<< Назад 77. Пересыщенные растворы. |
Вперед >>> 79. Давление пара растворов. |
- 69. Вода в природе.
- 70. Физические свойства воды.
- 71. Диаграмма состояния воды.
- 72. Химические свойства воды.
- 73. Характеристика растворов. Процесс растворения.
- 74. Способы выражения состава растворов.
- 75. Гидраты и кристаллогидраты.
- 76. Растворимость.
- 77. Пересыщенные растворы.
- 78. Осмос.
- 79. Давление пара растворов.
- 80. Замерзание и кипение растворов.
- «Шепот» звезд
- Клестовик
- 4.6.4. Сравнительная характеристика представителей типа Плоские черви
- НАВОЗНИКИ ГЕОТРУПЫ
- К истокам Кочурлы
- 2.2. Клетка – единица строения, жизнедеятельности, роста и развития организмов. Многообразие клеток. Сравнительная харак...
- Секретный рецепт
- «Бездонный» бокал
- 706. Какой экологический вред наносят морские миноги?
- ПОИСК ЭКСПЕРИМЕНТАЛЬНЫХ ДОКАЗАТЕЛЬСТВ
- Почему стемнело только к полуночи и ненадолго? Разве там нет ночи?
- Путешествовать помогает ветер
