Книга: Общая химия
65. Факторы, определяющие направление протекания химических реакций.
| <<< Назад 64. Смещение химического равновесия. Принцип Ле Шателье. |
Вперед >>> 66. Термодинамические величины. Внутренняя энергия и энтальпия. |
65. Факторы, определяющие направление протекания химических реакций.
В предыдущих параграфах мы рассмотрели несколько примеров, показывающих, что при определенных условиях каждая химическая реакция самопроизвольно протекает в определенном направлении. Так, при низких температурах экзотермическая реакция образования парообразной воды
2H2 + O2 = 2H2O + 486,6 кДж
практически нацело протекает в прямом направлении*. Но при высоких температурах эта реакция начинает идти в обратном направлении: водяной пар разлагается на водород и кислород. Во всех случаях в результате реакции может быть достигнуто состояние устойчивого химического равновесия, но само положение равновесия при разных условиях оказывается различным.
Возникает вопрос; в чем причина определенной направленности химических процессов, какие факторы обусловливают то или иное состояние химического равновесия?
Известно, что в механических системах устойчивое равновесие соответствует минимуму потенциальной энергии системы. Так, шарик самопроизвольно скатывается из положения а на наклонной поверхности (рис. 69), причем его потенциальная энергия переходит сначала в кинетическую энергию движения шарика как целого, а затем в энергию теплового движения молекул. В положении б шарик находится в равновесии.
Естественно предположить, что и химические процессы должны самопроизвольно протекать в направлении уменьшения внутренней энергии системы, т. е. в направлении, отвечающем положительному тепловому эффекту реакции. Действительно, опыт показывает, что при обычных условиях самопроизвольно протекают преимущественно экзотермические реакции.
Однако попытка объяснить направленность химических процессов только стремлением к минимуму внутренней энергии приводит к противоречиям с фактами.
* В отсутствие катализатора скорость этой реакции при обычных условиях крайне мала. однако при наличии катализаора (например, платинированного асбеста) процесс образования воды протекает с большой скоростью.
- 183 -
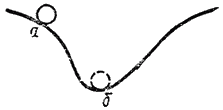
Рис. 69. Шарик самопроизвольно скатывается из положения а в положение б.
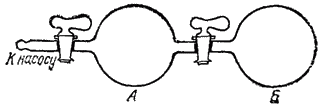
Рис. 70. Сосуд, состоящий из двух частей: в части А находится разреженный газ, в часта Б — вакуум.
Так, уже при обычных температурах самопроизвольно протекают эндотермические процессы растворения многих солей и некоторые эндотермические химические реакции. С повышением температуры все большее число реакций начинает самопроизвольно протекать в направлении эндотермического процесса; примерами таких реакций могут служить упомянутое выше разложение воды или протекающий при высоких температурах синтез оксида азота (II):
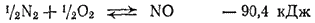
Более того, принцип стремления к минимуму внутренней энергии требует, чтобы все экзотермические реакции доходили до конца, т. е. исключает возможность обратимых реакций; однако такие реакции реально существуют.
Вспомним теперь, что среди механических систем имеются такие, поведение которых тоже нельзя описать только направленностью процессов к достижению минимума потенциальной энергии. Это системы, состоящие из очень большого числа частиц. Например, молекулы, входящие в состав воздуха, распределяются вокруг Земли в виде атмосферы многокилометровой толщины, но не падают на Землю, хотя минимуму потенциальной энергии каждой молекулы соответствует наиболее низкое ее положение.
Из громадного числа частиц состоят и химические системы. Поэтому неудивительно, что и здесь тенденция к достижению минимума внутренней энергии не является единственным фактором, определяющим их поведение.
Для того чтобы составить представление о втором факторе, влияющем на направление реакций, рассмотрим какой-либо самопроизвольно протекающий процесс, не сопровождающийся тепловым эффектом. Примером такого процесса может служить расширение разреженного газа.
Пусть в части А сосуда, разделенного на две части (рис. 70), находится разреженный газ. В таком газе среднее расстояние между молекулами велико; при этом условии внутренняя энергия газа не зависит от степени его разрежения. Вторая половина сосуда (Б) газа не содержит. Если открыть кран, соединяющий обе части сосуда, то газ самопроизвольно распространится по всему сосуду.
Внутренняя энергия газа при этом не изменится; тем не менее, самопроизвольно произойдет именно процесс расширения газа, а обратный процесс — самопроизвольное сжатие газа — не происходит.
Причины такой направленности процесса можно понять, если сначала рассмотреть систему, содержащую небольшое число молекул. Пусть в сосуде находятся всего две молекулы, которые обозначим 1 и 2. Равномерное распределение газа между обеими частями сосуда, соответствующее определенному макросостоянию газа, может осуществиться двумя микросостояниями;
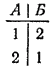
Макросостояние, при котором весь газ сосредоточен в одной из частей сосуда (например, в части А), осуществляется единственным микросостоянием:
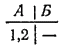
Очевидно, что то или иное макросостояние системы тем более вероятно, чем большим числом микросостояний оно может осуществиться. В рассматриваемом случае (две молекулы) равномерное распределение газа по сосуду вдвое вероятнее, чем переход всего газа в часть сосуда А.
Пусть теперь в сосуде находится четыре молекулы, которые мы вновь пронумеруем. Переходу всего газа в часть сосуда А по-прежнему соответствует единственное микросостояние:
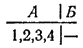
Между тем, равномерное распределение газа между обеими частями сосуда может теперь осуществляться шестью различными микросостояниями:
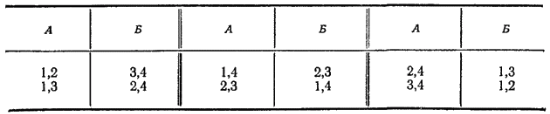
Теперь, следовательно, вероятность равномерного распределения молекул газа по всему объему сосуда оказывается заметно более высокой, чем вероятность их перехода в одну из его частей. Естественно, что равномерное распределение газа будет наблюдаться гораздо чаще, чем полное его сосредоточение в части сосуда.
Если в сосуде находится шесть молекул, то переходу их в одну из частей сосуда (т. е. самопроизвольному сжатию газа до половины занимаемого им первоначального объема), как и раньше, соответствует только одно микросостояние. Но равномерному распределению газа между обеими частями сосуда отвечает уже 20 возможных комбинаций молекул, т. е. 20 различных микросостояний:
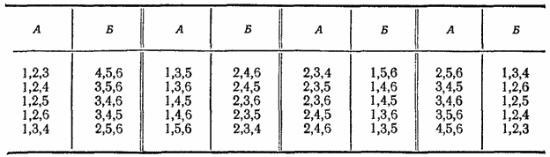
Теперь явление самопроизвольного сжатия газа, т. е. сосредоточения всех его молекул в одной из частей сосуда, будет наблюдаться еще реже; равномерное же распределение газа по всему сосуду становится еще более вероятным.
Таким образом, с ростом числа молекул вероятность беспорядочного, равномерного распределения газа в сосуде очень быстро возрастает, а самопроизвольное сжатие газа становится все менее вероятным процессом. Если мы вспомним теперь, что макроскопические количества газа содержат огромное число молекул, то станет ясно, что в реальном опыте самопроизвольное сжатие газа представляет собой процесс практически невозможный, и что самопроизвольно будет протекать обратный процесс расширения газа, приводящий к равномерному, беспорядочному распределению его молекул по всему объему сосуда.
Рассмотренное нами явление расширения газа представляет собой пример проявления принципа направленности процессов к наиболее вероятному состоянию, т. е. к состоянию, которому соответствует максимальная беспорядочность распределения частиц. Направление самопроизвольного протекания химических реакций и определяется совокупным действием двух факторов: тенденцией к переходу системы в состояние с наименьшей внутренней энергией и тенденцией к достижению наиболее вероятного состояния.
Так, в приведенном примере с воздухом тенденция к минимуму потенциальной энергии заставляет молекулы, входящие в состав воздуха, падать на Землю, а тенденция к максимальной вероятности заставляет их беспорядочно распределяться в пространстве.
В результате создается некоторое равновесное распределение молекул, характеризующееся более высокой их концентрацией у поверхности Земли и все большим разрежением по мере удаления от Земли.
В системах соль—вода минимум внутренней энергии в большинстве случаев соответствует кристаллическому состоянию соли. Однако наиболее вероятное состояние системы достигается при беспорядочном распределении соли в жидкой воде. В результате совместного действия этих двух факторов устанавливается равновесие, соответствующее определенной концентрации насыщенного раствора соли.
При химических реакциях в силу принципа направленности процессов к минимуму внутренней энергии атомы соединяются в такие молекулы, при образовании которых выделяется наибольшее количество энергии. В силу же принципа направленности процессов к наиболее вероятному состоянию протекают такие реакции, в ходе которых возрастает число частиц (например, реакции разложения молекул на атомы) или чисто возможных состояний атомов.
Так, в случае реакции
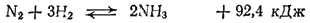
минимальной внутренней энергии системы соответствует аммиак, образующийся при протекании реакции до конца вправо. Однако наиболее вероятному состоянию системы отвечает азото-водородная смесь, образующаяся при полном разложении аммиака, ибо при этом в 2 раза возрастает число молекул газов. Вследствие действия обоих фактором в системе устанавливается равновесие, отвечающее определенному при данной температуре соотношению концентраций всех веществ.
В случае реакции

минимальной внутренней энергии отвечает азото-кислородная смесь, образующаяся при полном разложении оксида азота. Поскольку в ходе этой реакции число частиц не изменяется, то протекание реакции до конца как в прямом, так и в обратном направлении не увеличивает вероятности состояния системы. Не изменяется при этом и число возможных состояний атомов: в исходных веществах каждый атом и азота, и кислорода связан с атомом того же элемента (молекулы N2 и O2 ), а в продукте реакции каждый атом связан с атомом другого элемента (молекула NO). Иначе обстоит дело при частичном протекании процесса в прямом или в обратном направлении. В результате частичного прохождения реакции, т. е. при сосуществовании исходных веществ и продуктов реакции, атомы азота и кислорода находятся в двух состояниях: часть их связана в молекулы N2 и O2, а часть — в молекулы NO.
- 187 -
Таким образом, число возможных микросостояний рассматриваемой системы, а следовательно, и вероятность соответствующего ее макросостояния возрастают при частичном протекании реакции. Итак, тенденция к уменьшению внутренней энергии способствует протеканию данной реакции до конца в обратном направлении, а тенденция к увеличению вероятности состояния вызывает ее частичное протекание в прямом направлении. Вследствие одновременного действия обоих факторов часть азотокислородной смеси при нагревании превращается в NO и устанавливается равновесие между исходными веществами и продуктом реакции.
Тенденция к переходу в состояние с наименьшей внутренней энергией проявляется при всех температурах в одинаковой степени. Тенденция же к достижению наиболее вероятного состояния проявляется тем сильнее, чем выше температура. Поэтому при низких температурах в большинстве случаев практически сказывается только влияние первой из этих тенденций, в результате чего самопроизвольно протекают экзотермические процессы. По мере возрастания температуры равновесие в химических системах все больше и больше сдвигается в сторону реакций разложения или увеличения числа состояний атомов. При этом каждой температуре отвечает состояние равновесия, характеризующееся определенным соотношением концентраций реагирующих веществ и продуктов реакции.
Оба рассмотренных фактора, а также результат их совместного действия можно выразить количественно. Величины, с помощью которых это делается, изучаются в разделе физики — термодинамике и называются термодинамическими величинами. К ним относятся, в частности, внутренняя энергия, энтальпия, энтропия и энергия Гиббса.
| <<< Назад 64. Смещение химического равновесия. Принцип Ле Шателье. |
Вперед >>> 66. Термодинамические величины. Внутренняя энергия и энтальпия. |
- 54. Превращения энергии при химических реакциях.
- 55. Термохимия.
- 56. Термохимические расчеты.
- 57. Скорость химической реакции.
- 58. Зависимость скорости реакции от концентраций реагирующих веществ.
- 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
- 60. Катализ.
- 61. Скорость реакции в гетерогенных системах.
- 62. Цепные реакции.
- 63. Необратимые и обратимые реакции. Химическое равновесие.
- 64. Смещение химического равновесия. Принцип Ле Шателье.
- 65. Факторы, определяющие направление протекания химических реакций.
- 66. Термодинамические величины. Внутренняя энергия и энтальпия.
- 67. Термодинамические величины. Энтропия и энергия Гиббса.
- 68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
- Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
- Практическое значение смещенных реакций
- 1.5. Определяющие параметры физико-математических моделей
- 2.6. Биосинтез белка и нуклеиновых кислот. Матричный характер реакций биосинтеза. Генетическая информация в клетке. Гены...
- Как определить направление и время по солнцу и звездам
- § 48 Строение атома и свойства химических элементов
- Типы химических реакций.
- § 47 Периодический закон и периодическая система химических элементов Д. И. Менделеева
- Скорость и энергия химических реакций
- § 51 Скорость и энергия химических реакций
- Схемы и уравнения реакций.
- Глава 8 Биогенная миграция химических элементов и биогеохимические принципы
