Книга: Общая химия
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
| <<< Назад 67. Термодинамические величины. Энтропия и энергия Гиббса. |
Вперед >>> Глава VII. ВОДА, РАСТВОРЫ |
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Величина изменения энергии Гиббса при реакции зависит от температуры, а также от природы и концентрации взятых и получающихся веществ. Для удобства сопоставления различных реакций принято сравнивать значения ?G при стандартных условиях, т. е. при одинаковых концентрациях веществ (чистое состояние для индивидуальных веществ; концентрация, равная 1 моль в 1000 г растворителя, для растворов; парциальное давление, равное нормальному атмосферному давлению, для газов).
- 193 -
Состояние вещества, находящегося в стандартных условиях, называется стандартным состоянием.
Термодинамические величины, характеризующие вещество в его стандартном состоянии, называются стандартными величинами. Изменения термодинамических величин при реакции, в ходе которой исходные вещества в стандартном состоянии превращаются в продукты реакции, также находящиеся в стандартном состоянии, называются стандартными изменениями соответствующих величин. Стандартные величины и их изменения принято обозначать с помощью знака "°". Например, стандартная энтропия обозначается символом S°, стандартное изменение энтальпии — ?H°, стандартное изменение энергии Гиббса ?G°.
Стандартное изменение энергии Гиббса реакции связано с константой равновесия реакции уравнением:
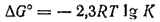
При подстановке значения R = 8.314 Дж/(моль·К) величина ?G° выразится формулой

Это уравнение дает возможность, зная ?G°, вычислять константу равновесия и, наоборот, по экспериментально найденному значению константы равновесия определять ?G° реакции. Оно справедливо для любой температуры, но чаще применяется для 25°С ; эта температура принимается в качестве стандартной. Температура указывается при этом нижним индексом
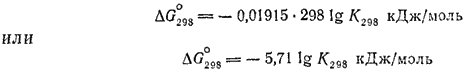
При вычислении стандартных изменений энтальпии и энергии Гиббса реакций обычно используют стандартные энтальпии и энергии Гиббса образования веществ. Эти величины представляют собой ?H° и ?G° реакций образования данного вещества из простых при стандартных условиях. При этом, если элемент образует несколько простых веществ, то берется наиболее устойчивое из них (при данных условиях). Энтальпия образования и энергия Гиббса образования наиболее устойчивых простых веществ принимаются равными нулю.
Согласно закону Гесса, стандартное изменение энтальпии реакции (сокращенно: стандартная энтальпия реакции) равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
- 194 -
Аналогично стандартное изменение энергии Гиббса реакции (сокращенно: стандартная энергия Гиббса реакции) равно сумме стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса образования исходных веществ. При этом все суммирования производятся с учетом числа молей участвующих в реакции веществ в соответствии с ее уравнением.
Таблица 7. Стандартная энтальпия образования и стандартная энергия Гиббса образования некоторых веществ при 298 К (25°С)
Сокращенные обозначения агрегатного состояния веществ: г — газообразное, ж — жидкое, к — кристаллическое.
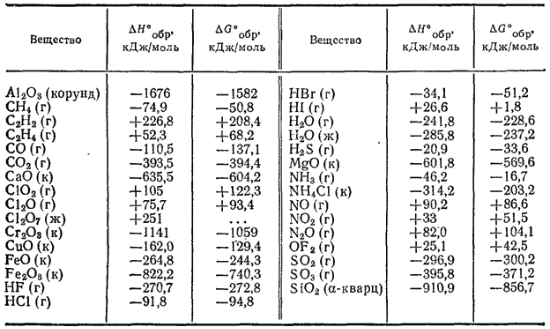
В табл. 7 приведены значения стандартных энтальпий и энергий Гиббса образования некоторых веществ при 25°С (298 К). Более полные данные этого рода можно найти в справочниках, например, в «Кратком справочнике физико-химических величин» под редакцией А. А. Равделя и А. М. Пономаревой (издание восьмое, 1983 г.).
Пример 1. Вычислить ?H°298 , тепловой эффект при 298 К и постоянном давлении и ?G°298 реакции:
Fe2O3 + 2Al = Al2O3 +2Fe
Вычисление ?H°298 и теплового эффекта реакции. Находим в табл. 7 ?H°обрFe2O3 (-822.2 кДж/моль) и Al2O3 (-1676 кДж/моль) при 298 К и производим алгебраическое суммирование:
?G°298 = -1676 -(-822,2) = -853,8 кДж
Поскольку изменение энтальпии реакции равно по величине, но обратно по знаку ее тепловому эффекту при постоянных температуре и давлении (см. стр. 189), то термохимическое уравнение ракции запишется следующим образом:
Fe2O3 + 2Al = Al2O3 +2Fe + 853,8 кДж
При низких температурах знак изменения энтальпии реакции может служить для ориентировочного определения возможного направления реакции. Полученное для рассматриваемой реакции отрицательное значение ?H° указывает на возможность ее самопроизвольного протекания при достаточно низких температурах; при этом большое абсолютное значение ?H° позволяет с достаточной вероятностью предполагать, что в условиях, не очень сильно отличающихся от стандартных, эта реакция тоже может протекать в прямом направлении.
Вычисление ?G°298 реакции. Находим в табл. 7 ?G°обрFe2O3 (-740.3 кДж/моль) и Al2O3 (-1582 кДж/моль) при 298 К и производим суммирование:
?G°298 = -1582 - (-740,3)= -831,7 кДж
Полученное отрицательное значение ?G°298 подтверждает вывод, сделанный на основе оценки ?H°298 реакции. Близость найденных значений ?H°298 и ?G°298 связана, в частности, с тем, что при протекании рассматриваемой реакции не меняется число молекул газов (в нашем примере ни исходные вещества, ни продукты реакции не являются газами). При изменении же числа молекул Газов может существенно изменяться энтропия системы (переход в газообразное состояние сопровождается сильным возрастанием молекулярного беспорядка!), вследствие чего значения ?H° и ?G° могут не только заметно различаться по величине, но даже иметь разные знаки (см. пример 2). Поэтому в подобных случаях знак ?H° не может служить определенным критерием направления самопроизвольного протекания реакции.
Большое абсолютное значение ?G°298, найденное для рассматриваемой реакции, позволяет с достаточной вероятностью говорить о возможности протекания этой реакции в прямом направлении не только при стандартной температуре (25°C), но и при других температурах. В случае малых абсолютных значений ?G°298, а также для реакций, протекающих с изменением числа молекул уазов, такого заключения делать нельзя; в подобных случаях нужно знать зависимость ?G° от температуры.
Пример 2. Вычислить ?H°298, тепловой эффект при 298 К и постоянном давлении ?G°298 реакции:
CuO + C = Cu + CO
Вычисление ?H°298 реакции. Находим в табл. 7 ?H°обрCuO(-162.0 кДж/моль) и СО (-110.5 кДж/моль) при 298 К и производим суммирование:
?H°298 = -110,5 - (- 162,0) = 51,5 кДж
Таким образом
CuO + C = Cu + CO - 51,5 кДж
Полученное значение ?H°298 положительно, но мало по абсолютной величине. Поэтому оно не может служить критерием направления протекания реакции даже при невысоких температурах, тем более, что в рассматриваемом случае в результате реакции изменяется число молекул газов.
Вычисление ?G°298 реакции. Находим в табл. 7 ?G°обрCuO(-129.4 кДж/моль) и СО (-137.1 кДж/моль) при 298 К и производим суммирование:
?G°298 = - 137,1 - (-129,4) = - 7,7 кДж
Полученное значение ?G°298 тоже мало по абсолютной величине, но отрицательно. Оно указывает на возможность протекания реакции в прямом направлении при стандартных условиях, по не дает оснований для выводов о ее направлении при условиях, отличающихся от стандартных.
В данном примере разные знаки ?H°298 и ?G°298 объясняются возрастанием в ходе реакции числа молекул газов и связанным с этим увеличением энтропии. Именно поэтому оказывается возможным самопроизвольное протекание эндотермической реакции восстановления меди.
Пример 3. Вычислить константу равновесия реакции:
NH3 + HCl = NH4Cl
Прежде всего определим ?G°298 реакции. Для этого находим в табл. 7 ?G°298 NH3 (-16.7 кДж/моль), HCl (-94.8 кДж/моль) и NH4Cl (-203.2 кДж/моль) при 298 К и производим суммирование:
?G°298 = -203,2 -(-16,7 - 94,8) = -91,7 кДж
Теперь найденное значение ?G°298 подставляем в уравнение (см. стр. 193)
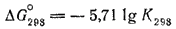
Получаем:
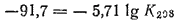
Отсюда
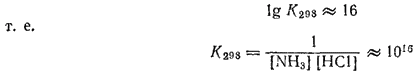
Большое значение найденной нами константы показывает, что при стандартной температуре равновесие
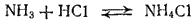
сильно смещено вправо; иначе говоря, при 25°C хлорид аммония — устойчивое соединение.
| <<< Назад 67. Термодинамические величины. Энтропия и энергия Гиббса. |
Вперед >>> Глава VII. ВОДА, РАСТВОРЫ |
- 54. Превращения энергии при химических реакциях.
- 55. Термохимия.
- 56. Термохимические расчеты.
- 57. Скорость химической реакции.
- 58. Зависимость скорости реакции от концентраций реагирующих веществ.
- 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
- 60. Катализ.
- 61. Скорость реакции в гетерогенных системах.
- 62. Цепные реакции.
- 63. Необратимые и обратимые реакции. Химическое равновесие.
- 64. Смещение химического равновесия. Принцип Ле Шателье.
- 65. Факторы, определяющие направление протекания химических реакций.
- 66. Термодинамические величины. Внутренняя энергия и энтальпия.
- 67. Термодинамические величины. Энтропия и энергия Гиббса.
- 68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
- 67. Термодинамические величины. Энтропия и энергия Гиббса.
- Определение величины стресса
- Нестандартные репликаторы: дарвиновская эволюция без участия генов
- Разговор с нейрохимиком о любви
- Таблица 6.3. Значения видимой звездной величины астероидов (? = 60°)
- Таблица 4.1. Кеплеровские элементы орбиты и звездные величины комет, MOID которых меньше 0,1 а.е.
- Таблица 3.5. Диаметры астероидов в зависимости от их абсолютной звездной величины и принятого значения альбедо
- Какой величины луна
- ВТОРОЙ ЗАКОН ДВИЖЕНИЯ Глава четвертая поясняет, что всякое изменение количества движения зависит от величины приложенной...
- 9.4.2. Стандартные ациклические движения
- ЛИСТЬЯ НЕОБЫЧНОЙ ФОРМЫ И ВЕЛИЧИНЫ
- 9.4.1. Стандартные циклические движения
