Книга: Общая химия
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
| <<< Назад 58. Зависимость скорости реакции от концентраций реагирующих веществ. |
Вперед >>> 60. Катализ. |
59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
Молекулярно-кинетическая теория газов и жидкостей дает возможность подсчитать число соударений между молекулами тех или иных веществ при определенных условиях.
- 167 -
Если воспользоваться результатами таких подсчетов, то окажется, что число столкновений между молекулами веществ при обычных условиях столь велико, что все реакции должны протекать практически мгновенно. Однако в действительности далеко не все реакции заканчиваются быстро. Это противоречие можно объяснить, если предположить, что не всякое столкновение молекул реагирующих веществ приводит к образованию продукта реакции. Для того чтобы произошла реакция, т. е. чтобы образовались новые молекулы, необходимо сначала разорвать или ослабить связи между атомами в молекулах исходных веществ. На это надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение будет неэффективным— не приведет к образованию новой молекулы. Если же кинетическая энергия сталкивающихся молекул достаточна для ослабления или разрыва связей, то столкновение может привести к перестройке атомов и к образованию молекулы нового вещества.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции. Энергию активации выражают в кДж/моль. Молекулы, обладающие такой энергией, называются активными молекулами.
С ростом температуры число активных молекул возрастает. Отсюда следует, что и скорость химической реакции должна увеличиваться с повышением температуры. Действительно, при возрастании температуры химические реакции протекают быстрее.
Для того чтобы лучше понять ускоряющее действие температуры на химические реакции, рассмотрим, как распределяются молекулы вещества по величине их энергии. В качестве примера на рис. 63 показано такое распределение для газа, находящегося при постоянной температуре. По горизонтальной оси отложена энергия Е одной молекулы газа, а по вертикальной- доля общего числа молекул, обладающих энергией, лежащей в узком интервале от Е до E + ?E , деленная на величину этого интервала ?E. Если общее число молекул газа обозначать через N, а их долю, обладающую энергией, лежащей в указанном интервале, через ?N/N, то откладываемая по оси ординат величина будет равна ?N/(N?E).
Рассмотрим столбик шириной ?E и высотой, равной ординате кривой (см. рис. 63). Площадь такого столбика будет равна ?E·?N/(N?E)=?N/N, т. е. доле молекул, энергия которых лежит в интервале ?E. Аналогично площадь, ограниченная кривой, двумя ординатами (например, ординатами, отвечающими значениям энергии E1 и E2) и осью абсцисс (участок E1ABE2 на рис. 63), равна доле молекул газа, энергия которых лежит в данном промежутке- в нашем случае в промежутке от E1 до E2. Точно так же площадь, лежащая под кривой и ограниченная слева ординатой (например, ординатой, отвечающей E3), равна доле молекул, энергия которых превышает значение E3 (участок на рис. 63, покрытый сеткой).
Площадь, ограниченная всей кривой и осью абсцисс, равна единице.

Рис. 63. Распределение молекул газа по кинетической энергии. Площадь участка E1ABE2 равна доле молекул, энергия которых находится в интервале от E1 до E2. Площадь участка, покрытого сеткой, равна доле молекул, энергия которых превышает E3.
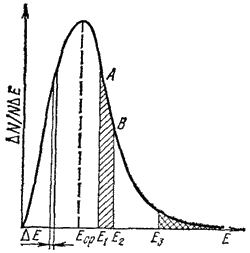
Рис. 64. Распределение молекул газа по кинетической энергии для двух температур T1 и T2(T2 > T1)
E2 - энергия активации. Площади заштрихованных участков выражают доли активных молекул при температурах T1 и T2.
- 168 -
Кривая на рис. 63 показывает, что молекулы газа, находящегося при постоянной температуре, обладают различной энергией. Наибольшая часть их имеет энергию, равную некоторой средней величине Eср или близкую к ней. Но имеются молекулы, энергия которых больше или меньше Eср. При этом, чем сильнее отличается энергия от Eср, т. е. чем дальше от максимума расположена точка кривой, тем меньшая доля молекул газа обладает такой энергией.
Как изменится кривая при изменении температуры? На рис. 64 показаны две кривые, отвечающие одному и тому же количеству газа, находящегося при температуре T1 и T2(T2 > T1). Видно, что кривая, относящаяся к температуре T2, смещена вправо — в сторону более высоких энергий.
Если на рис. 64 отметить энергию активации Ea какой-либо реакции, протекающей с участием данного газа, то будет видно, что доля молекул газа, энергия которых превышает Ea, резко возрастает с повышением температуры.
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции — числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент различных реакций различен. При обычных температурах его значение для большинства реакций лежит в пределах от 2 до 4.
Это на первый взгляд небольшое значение температурного коэффициента обусловливает, однако, большое возрастание скорости реакции при значительном повышении температуры. Например, если температурный коэффициент равен 2,9, то при возрастании температуры на 100 градусов скорость реакции увеличивается в 2,910, т. е. приблизительно в 50 000 раз.
Энергия активации различных реакций различна. Ее величина является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции. Для некоторых реакций энергия активации мала, для других, наоборот, велика.
Если энергия активации очень мала (меньше 40 кДж/моль), то это означает, что значительная часть столкновений между частицами реагирующих веществ приводит к реакции. Скорость такой реакции велика. Примером реакций, энергия активации которых ничтожно мала, могут служить ионные реакции в растворах, сводящиеся обычно к взаимодействию разноименно заряженных ионов; опыт показывает, что такие реакции протекают практически мгновенно.
Напротив, если энергия активации реакции очень велика (больше 120 кДж/моль), то это означает, что лишь очень малая часть столкновений взаимодействующих частиц приводит к протеканию химической реакции. Скорость подобной реакции очень мала. Примером реакции, имеющей высокую энергию активации, является реакция синтеза аммиака:
N2 + 3H2 = 2NH3
Эта реакция при обычных температурах протекает столь медленно, что заметить ее протекание практически невозможно.
Наконец, если энергия активации реакции не очень мала и не очень велика (40—120 кДж/моль), то такая реакция будет протекать не очень быстро и не очень медленно. Скорость такой реакции можно измерить. Примером реакции, протекающей с измеримой скоростью, может служить приведенная выше реакция разрушения тиосульфата натрия серной кислотой (см. стр. 164).
Реакции, требующие для своего протекания заметной энергии активации, начинаются с разрыва или с ослабления связей между атомами в молекулах исходных веществ. При этом вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом. Именно для его образования и необходима энергия активации. Неустойчивый активированный комплекс существует очень короткое время. Он распадается с образованием продуктов реакции; при этом энергия выделяется.
В простейшем случае активированный комплекс представляет собою конфигурацию атомов, в которой ослаблены старые связи и образуются новые.
- 170 -
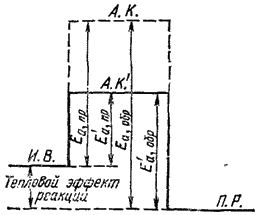
Рис. 65. Энергетическая схема реакции:
И.В. — исходные вещества; А.К. — активированный комплекс; П.Р. - продукты реакции; Еа, пр - энергия активации прямой реакции; Еа, обр — энергия активации обратной реакций.
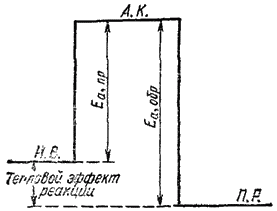
Рис. 66. Энергетическая схема реакции, протекающей с участием катализатора:
И.В. — исходные вещества; А.К. - активированный комплекс без катализатора; A.K'. - комплекс в присутствии катализатора; П.Р. — продукты реакции; Еа, пр — энергия активации прямой реакции без катализатора; Е'а, пр - то же в присутствии катализатора; Еа, обр - активации обратной реакции без катализатора; Е'а, обр — то же в присутствии катализатора.
Примером может служить схема реакции синтеза иодоводорода:
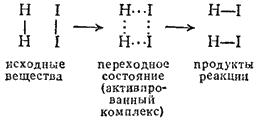
Активированный комплекс возникает в качестве промежуточного состояния в ходе как прямой, так и обратной реакции. Энергетически он отличается от исходных веществ на величину энергии активации прямой реакции, а от конечных — на энергию активации обратной реакции. Эти соотношения показаны на рис. 65; видно, что разность энергий активации прямой и обратной реакции равна тепловому эффекту реакции.
| <<< Назад 58. Зависимость скорости реакции от концентраций реагирующих веществ. |
Вперед >>> 60. Катализ. |
- 54. Превращения энергии при химических реакциях.
- 55. Термохимия.
- 56. Термохимические расчеты.
- 57. Скорость химической реакции.
- 58. Зависимость скорости реакции от концентраций реагирующих веществ.
- 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
- 60. Катализ.
- 61. Скорость реакции в гетерогенных системах.
- 62. Цепные реакции.
- 63. Необратимые и обратимые реакции. Химическое равновесие.
- 64. Смещение химического равновесия. Принцип Ле Шателье.
- 65. Факторы, определяющие направление протекания химических реакций.
- 66. Термодинамические величины. Внутренняя энергия и энтальпия.
- 67. Термодинамические величины. Энтропия и энергия Гиббса.
- 68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
- Глава IV КРУГОВОРОТ ЖИЗНИ И КРУГОВОРОТ ВЕЩЕСТВА В ПРИРОДЕ
- § 46. Типы обмена веществ у организмов
- Глава I Аварии с выбросом загрязняющих веществ в атмосферу и вопросы их математического моделирования
- Живое и минеральное вещество
- Приложение № 2 Токсические свойства и медико-биологические характеристики сильнодействующих ядовитых веществ
- § 40. Круговорот веществ и энергии в биосфере
- Микробы вырабатывают красящие вещества
- 1.4. Типизация выбросов загрязняющих веществ в атмосферу
- 5.1. Вредные вещества, поступающие в атмосферу при пожарах
- 2. Аллергические реакции. Особенности инфекционной аллергии
- 3.10. Высота стабилизации вещества выброса
- Зависимость электрической активности рыб от условий среды
