Книга: Общая химия
62. Цепные реакции.
| <<< Назад 61. Скорость реакции в гетерогенных системах. |
Вперед >>> 63. Необратимые и обратимые реакции. Химическое равновесие. |
62. Цепные реакции.
До сих пор мы рассматривали химические реакции, протекающие сравнительно просто. В таких реакциях каждый элементарный акт взаимодействия — каждое столкновение между активными молекулами реагирующих веществ — протекает независимо от результатов предшествующих элементарных актов. Образование макроскопических количеств продукта реакции является здесь результатом большого количества этих независящих друг от друга актов.
Существует, однако, обширная группа реакций, протекающих более сложно. В этих реакциях возможность протекания каждого элементарного акта сопряжена с успешным исходом предыдущего акта и, в свою очередь, обусловливает возможность последующего. Здесь образование макроскопических количеств продукта реакции представляет собой результат цепи элементарных актов взаимодействия. Такие реакции называются цепными.
Цепные реакции протекают с участием активных центров — атомов, ионов или радикалов (осколков молекул), обладающих неспаренными электронами и проявляющих, вследствие этого, очень высокую реакционную активность.
Роль активных центров могут играть, например, атомы
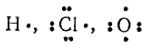
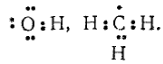
При актах взаимодействия активных центров с молекулами исходных веществ образуются молекулы продукта реакции, а также новые активные частицы — новые активные центры, способные к акту взаимодействия. Таким образом, активные центры служат создателями цепей последовательных превращений веществ.
Простым примером цепной реакции может служить реакция синтеза хлороводорода
H2 + Cl2 = 2HCl
Эта реакция вызывается действием света. Поглощение кванта лучистой энергии hv молекулой хлора приводит к ее возбуждению — к появлению в ней энергичных колебаний атомов. Если энергия колебаний превышает энергию связи между атомами, то молекула распадается. Этот процесс фотохимической диссоциации можно выразить уравнением:
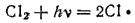
Образующиеся атомы хлора легко реагируют с молекулами водорода:
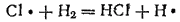
Атом водорода, в свою очередь, легко реагирует с молекулой хлора:
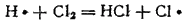
Эта последовательность процессов продолжается дальше: в рассматриваемом случае число звеньев может достигать 100 000. Иначе говоря, один поглощенный квант света приводит к образованию до ста тысяч молекул HCl. Заканчивается цепь при столкновении свободного атома со стенкой сосуда, в котором происходит реакция. Цепь может аакончиться также при таком соударении двух активных частиц и одной неактивной, в результате которого активные частицы соединяются в молекулу, а выделяющаяся энергия уносится неактивной частицей. В подобных случаях происходит обрыв цепи.
Таков механизм цепной керазветвленной реакции; при каждом элементарном взаимодействии один активный центр образует кроме молекулы продукта реакции один новый активный центр.
В двадцатых годах XX века Н. Н. Семенов совместно с сотрудниками, изучая кинетику различных процессов, открыл явления, необъяснимые на основе существовавших в то время представлений о механизме химических реакций. Для их объяснения Н. Н. Семенов выдвинул теорию разветвленных цепных реакций, в ходе которых взаимодействие свободного радикала с молекулой исходного вещества приводит к образованию не одного, а двух или большего числа новых активных центров. Один из них продолжает старую цепь, а другие дают начало новым; цепь разветвляется, и реакция прогрессивно ускоряется.
К разветвленным цепным реакциям относится, например, реакция образования воды из простых веществ. Экспериментально установлен и подтвержден расчетами следующий механизм этой реакции. В смеси водорода с кислородом при нагревании или пропускании электрического разряда происходит взаимодействие молекул этих газов с образованием двух гидроксильных радикалов:
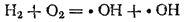
Радикалы ·OH легко реагируют с молекулой водорода
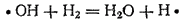
что приводит к образованию молекулы воды и свободного атома водорода. Последний реагирует с молекулой O2, давая уже две новых активных частицы:
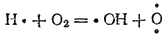
Атом кислорода, реагируя с молекулой H2 , в свою очередь, может породить два новых активных центра:
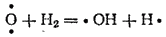
Таким образом происходит прогрессивное увеличение числа активных частиц и, если обрывы цепей не препятствуют этому процессу, скорость реакции резко возрастает.
По цепному механизму протекают такие важные химические реакции, как горение, взрывы, процессы окисления углеводородов (получение спиртов, альдегидов, кетонов, органических кислот) и реакции полимеризации. Поэтому теория цепных реакций служит научной основой ряда важных отраслей техники и химической технологии.
К цепным процессам относятся и ядерные цепные реакции, протекающие, например, в атомных реакторах или при взрыве атомной бомбы. Здесь роль активной частицы играет нейтрон, проникновение которого в ядро атома может приводить к его распаду, сопровождающемуся выделением большой энергии и образованием новых свободных нейтронов, продолжающих цепь ядерных превращений.
| <<< Назад 61. Скорость реакции в гетерогенных системах. |
Вперед >>> 63. Необратимые и обратимые реакции. Химическое равновесие. |
- 54. Превращения энергии при химических реакциях.
- 55. Термохимия.
- 56. Термохимические расчеты.
- 57. Скорость химической реакции.
- 58. Зависимость скорости реакции от концентраций реагирующих веществ.
- 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
- 60. Катализ.
- 61. Скорость реакции в гетерогенных системах.
- 62. Цепные реакции.
- 63. Необратимые и обратимые реакции. Химическое равновесие.
- 64. Смещение химического равновесия. Принцип Ле Шателье.
- 65. Факторы, определяющие направление протекания химических реакций.
- 66. Термодинамические величины. Внутренняя энергия и энтальпия.
- 67. Термодинамические величины. Энтропия и энергия Гиббса.
- 68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
- 63. Необратимые и обратимые реакции. Химическое равновесие.
- 2. Аллергические реакции. Особенности инфекционной аллергии
- Тип стрессорной реакции – А или Б – генетически детерминирован
- Результат выработки реакции избегания незнакомых людей
- Устойчивость к стрессорным ситуациям – это скорость угасания стрессорной реакции
- Скорость угасания реакции
- Эндокринные реакции после неконтролируемого стресса у представителей типа А и Б
- Метод выработки реакции избегания незнакомых людей и домашних животных
- 3.6. Изменчивость признаков у организмов: модификационная, мутационная, комбинативная. Виды мутаций и их причины. Значен...
- § 50 Химические реакции
- Факторы, влияющие на скорость химической реакции.
- Экзо– и эндотермические реакции.
