Книга: Эректус бродит между нами. Покорение белой расы
Глава 13. Гены
| <<< Назад Глава 12. Поведение |
Вперед >>> Глава 14. Интеллект |
Разделы на этой странице:
Глава 13. Гены
«Какое бы преимущество эти гены [ASPM и MCPH1] ни давали, у некоторых групп людей они есть, а у других нет. Это должно стать сущим кошмаром для тех, кто убежден, что между группами нет никаких различий в функционировании мозга».
Антрополог Джон Хоукс
Противники расовой теории, утверждающие, что нет такой сущности, как раса, сталкиваются с затруднениями, когда требуется объяснить, почему при картировании генетических различий между коренными популяциями во всем мире результат практически точно совпадает с картой распределения рас (рис. 7–4). Таким образом, нет сомнения в том, что гены у разных популяций различаются.
Все признаки, обсуждавшиеся в предыдущих главах, хотя бы отчасти обусловлены генами, и в этой мере можно утверждать, что «биология – это судьба» (Зигмунд Фрейд). Генетика только недавно смогла идентифицировать некоторые из генов, ответственных за упомянутые признаки, и лишь совсем недавно сведения о расовых различиях в идентифицированных генах были опубликованы. Хотя все люди имеют одинаковые гены, в каждой популяции доля лиц с конкретной аллелью изменяется от 0 (ни у кого в популяции нет такой аллели) до 100 % (аллель присутствует у каждого представителя популяции, то есть является «закрепленной»).
Было бы полезно составить список распространенности в мире всех важных аллелей человека, существенно различающихся у представителей разных популяций, но такая информация пока еще не доступна. Здесь будут названы некоторые гены, связанные с размером мозга и уровнем интеллекта (Weiss, 1992; Plomin, 2004), поведением, особенностями кожи, волос и глаз, а также болезнями, которые либо уже известны как специфичные для некоторых популяций, либо с большой вероятностью должны различаться в разных популяциях.
Мозг и уровень интеллекта
NBPF15 («neuroblastoma breakpoint family, member 15», или MGC8902), хромосома 1. Этот ген кодирует множественные копии белка DUF1220, который экспрессируется в областях мозга, связанных с высшими когнитивными функциями. Более того, последовательности этого гена различны у разных приматов, и по мере приближения к человеку число дупликатных копий повышается до 212 (Popesco, 2006). Сведения об индивидуальных и расовых различиях в числе копий до сих пор не публиковались.
DAB1 («disabled-1»), хромосома 1. Этот ген отвечает за структуру клеточных слоев в коре головного мозга – области, связанной с высшими когнитивными функциями. Вариант этого гена широко распространился в китайской, но не в других популяциях (Williamson, 2007).
ASPM («abnormal spindle homolog, microcephaly associated»), хромосома 1. Его аллели влияют на размер мозга; дефекты этого гена ведут к недоразвитию мозга и низкому IQ (Evans, 2004). Новая аллель гена ASPM возникла примерно 5800 лет назад в Евразии; предполагается, что с ней связано повышение интеллекта у евразийского населения; обычно она встречается у аборигенов Евразии, но отсутствует у африканцев и шимпанзе. У людей, говорящих на тональных языках (таких как китайский), вероятнее наличие двух более новых аллелей ASPM и MCPH1 (Dediu, 2007; Mekel-Bobrov, 2005).
MCPH1 («microcephaly, primary autosomal recessive 1»), хромосома 8. Аллели этого гена, обычно называемого «микроцефалин», хотя бы частично определяют размер и/или структурную организацию мозга (Wang, 2004). Новая аллель этого гена, способствующая повышению интеллекта, возникла примерно 37 000 лет назад (доверительный интервал очень широк – от 60 до 14 тысяч; Evans, 2005). Эта аллель типична для аборигенов Евразии, но редко встречается у африканцев и отсутствует у шимпанзе.
Аллели ASPM и микроцефалина подвергались серьезному отбору и быстро распространились в евпропейских популяциях. Эти гены были связаны в хронологическом порядке с двумя наиболее революционными изменениями – появлением орудий труда в верхнем палеолите (40 000 лет назад), а также формированием городов и появлением крупных торговых путей. Однако корреляция между IQ и наличием этих аллелей пока не обнаружена (Woods, 2006; Rushton, 2007a).
DCDC2 («double cortin domain containing 2»), хромосома 6. Этот ген влияет на формирование областей мозга, ответственных за функцию чтения (Weiss, 2005). Одна из аллелей может приводить к развитию дизлексиии (Meng, 2005).
NQO2 («Homo sapiens quinone oxidoreductase 2»), хромосома 6. Этот ген оказывает очевидное влияние на мозговую активность и может влиять на IQ, но данные об этом, а также о распределении данного гена в разных популяциях еще не опубликованы.
IGF2R («insulin-like growth factor 2 receptor»), хромосома 6. Это был первый обнаруженный ген, имеющий отношение к уровню интеллекта; носительство одной из аллелей этого гена повышает IQ примерно на 4 балла (Chorney, 1998).
DTNBP1 («dystrobrevin binding protein 1»), хромосома 6. Он связан с шизофренией; недавно обнаружена связь с уровнем интеллекта (Burdick, 2006).
CHRM2 («cholinergic receptor, muscarinic 2»), хромосома 7. Активирует сигнальные пути в мозге; некоторые аллели могут повышать IQ на 15–25 баллов (Dick, 2007; Gosso, 2006).
FoxP2 («forkhead box P2»), хромосома 7, влияет на языковые способности, включая грамматику, а также на IQ. Этот ген присутствует и у многих животных, но у человека за последние 200 000 лет возникла его аллель, которая подверглась тщательному эволюционному отбору, поскольку более развитые способности коммуникации и творчества, связанные с этой аллелью, обеспечивали ее носителям существенные адаптационные преимущества.
EMX2 («Empty spiracles-like protein»), хромосома 10. Отвечает за развитие специализированных областей коры. Другие области коры функционируют менее эффективно (Leingдrtner, 2007).
FADS2 («fatty acid desaturase 2»), хромосома 11. Этот ген вовлечен в образование омега-3-жирных кислот, необходимых для питания мозга. У детей, находящихся на грудном вскармливании, аллель этого гена повышает IQ на 6–10 баллов (Caspi, 2007).
DARPP-32 («dopamine– and cyclic AMP-regulated phosphoprotein»), хромосома 17. Одна из аллелей этого гена оптимизирует функции областей мозга, ответственных за мышление, но повышает риск шизофрении (Meyer-Lindenberg, 2007).
MAPT («microtubule-associated protein tau»), хромосома 17. Мутации этого гена могут вызывать нейродегенеративные заболевания. H2-галотип этого гена мог быть унаследован от неандертальцев (Hardy, 2005). Согласно предположению физика и математика Роджера Пенроуза, сознание – это квантовый эффект, возникающий в микротубулах, кодируемых данным геном (Shadows of the Mind, 1996).
PDYN («prodynorphin»), хромосома 20. Кодирует молекулу – предшественника нейропептидов, влияющих на чувственное восприятие, поведение и память (Balter, 2005).
HAR1 RNA («human accelerated region 1»), хромосома 20. Кодирует РНК, влияющую на развитие нейронов в новой коре мозга. Этот ген различен у человека и шимпанзе; у человека он быстро эволюционирует (Pollard, 2006). Также см. HAR1F, который активен в особых клетках, появляющихся в раннем эмбриональном развитии и участвующих в формировании коры головного мозга у человека; ген HAR1 отвечает за синтез РНК, не кодирующей белок (Smith, K., 2006; Pollard, 2006).
EST00083 («expressed sequence tag») – полиморфизм митохондриальной ДНК, обнаруживаемый чаще всего в группах лиц с высоким IQ. Особенно распространен в Европе (меньше в Азии), где связан с линией родства, существующей 35 000 лет (Thomas, 1998). < >
Поведение
ADH («alcohol dehydrogenase»), хромосома 4. Мутации этого гена вызывают у монголоидов более интенсивную реакцию на алкоголь, включая более выраженное покраснение лица (Duranceaux, 2006).
PAX6 («paired box gene 6»), хромосома 11. Контролирует развитие радужки. Мутация этого гена связана с импульсивностью и низким уровнем социализации; о ее наличии могут свидетельствовать особенности радужки (Larsson, 2001).
DRD4 («dopamine receptor D4»), хромосома 11. Контролирует половое влечение (Zion, 2006). По данным некоторых исследований, в двух европейских популяциях аллель связана с личностной чертой, выражающейся в стремлении к новым впечатлениям (Benjamin, 1996), но в других исследованиях эти данные не подтверждаются.
ACTN3 («alpha-actinin-3»), хромосома 11. Кодирует быстро сокращающиеся мышечные волокна. Аллель R кодирует функциональную копию белка, а аллель X не участвует в синтезе белка; 25 % монголоидов, 18 % европеоидов и менее чем 1 % африканской популяции банту дефицитны по этому гену (Yang, 2003).
AVPR1a (arginine vasopressin 1a receptor), хромосома 12. Влияет на социальную сплоченность и альтруизм у человека и некоторых животных. Лица с длинным промотером аллели RS3 более альтруистичны, чем лица с коротким промотером (Knafo, 2007).
ACE («angiotensin I-converting enzyme»), хромосома 17. Преобразует ангиотензин I в ангиотензин II, но также связан с атлетическими возможностями человека. О расовых различиях пока не известно.
MAOA («monoamine oxidase A»), хромосома X. Этот ген отвечает за синтез фермента, располагающегося на митохондриальных мембранах в нервных клетках и расщепляющего ряд важных нейромедиаторов, включая те, которые, как считается, участвуют в регуляции уровня агрессивности и импульсивности (Moran, 2006). Лица с коротким вариантом MAOA более импульсивны и в целом более антисоциальны, чем лица с длинным вариантом. Лица с низким уровнем моноаминоксидазы типа А, не подвергавшиеся лечению в детском возрасте, существенно чаще совершают преступления (Moffitt, 2005; Meyer-Lindenberg, 2006). У разных этнических групп аллели различны.
Кожа, волосы и глаза
EDAR («ectodysplasin A receptor»), хромосома 2. Контролирует толщину волос. Жители Восточной Азии обладают двумя аллелями этого гена, делающими их волосы более толстыми (Am. Soc. of Human Gen., Annual Meeting, Oct. 23–27, 2007).
MATP («melanoma antigen transporter protein»), хромосома 5, влияет на цвет волос. «Мутация L374F присутствовала у 96 % германцев, а среди японцев она полностью отсутствовала» (Yuasa, 2004). Есть как минимум 118 генов, связанных с пигментацией волос (Lao, 2007).
AIM1 («absent in melanoma 1»), хромосома 6, влияет на цвет волос. Аллель 272K распространена среди азиатских популяций, таких как китайцы (43,4 %), сингальцы (20,4 %) и тамилы (12,1 %), но редко встречается среди европеоидов (2,5 %), койсанов (бушмены 3,4 %) и ганцев (4,1 %). Аллель 374F встречается исключительно у европеоидов (91,6 %) и почти отсутствует в других пяти популяциях (от 0 до 1,9 %) (Soejima, 2006).
TYR («Tyrosinase»), хромосома 11. Этот ген и ген MATP играют главнейшую роль в эволюции цвета кожи у европеоидов, но не у жителей Восточной Азии, у которых цвет кожи эволюционировал независимо (Norton, 2006).
KITLG («KIT legand»), хромосома 12. Около 20 % различий в пигментации кожи между жителями Африки и Северной Европы обусловлены различными аллелями этого гена (Miller, 2007).
OCA2 («oculocutaneous albinism II»), хромосома 15. Этот ген может вызвать альбинизм, но его структура различна у европеоидов и афроамериканцев (Lee, 1994). Также влияет на цвет глаз (Duffy, 2007).
HERC2, («HECT domain and RCC1-like domain-containing protein 2»), хромосома 15, может снижать продукцию темного пигмента (меланина), вызываемую смежным геном OCA2, что приводит к формированию голубых глаз, светлых волос и светлой кожи; 97 % голубоглазых людей обладают одной и той же аллелью этого гена. Высокая частота аллели голубоглазости в Скандинавии указывает на то, что эта аллель существенно повышала репродуктивный успех ее носителя (Eiberg, 2008).
SLC24A5 («solute carrier family 24, member 5», или «the golden pigmentation gene»), хромосома 15. Аллель этого гена, вызывающая одиночную аминокислотную замену, является главной причиной более светлого цвета кожи у европеоидов по сравнению с африканцами (Lamason, 2005). Этот ген также экспрессируется в мозге [166 - GeneCard for protein coding SLC24A5 GC15P046200.].
MC1R («melanocortin-1 receptor»), хромосома 16. Существует более 30 аллелей этого гена. Данный ген влияет на цвет волос и кожи, но не на цвет глаз (Mueller, 2006). У африканцев (и вообще у жителей тропиков) имеется предковая аллель этого гена и только тождественные аллели (то есть аллели, кодирующие одни и те же аминокислоты) этого гена; аллели являются древними и кодируют синтез эумеланина, придающего темный цвет коже и волосам (Harding, 2000). У европеоидов имеются аллели, ответственные за белый, рыжий, коричневый и черный цвет волос.
KRT41P, или KRTHAP1 («keratin 41 pseudogene»), хромосома 17. Этот ген присутствует у шимпанзе, горилл и у человека и отвечает за волосяной покров на теле. У человека он был отключен примерно 240 000 лет назад (Klein, 2002, с. 203).
EYCL1 («eye color 1», или «gey»), хромосома 19, отвечает за зеленый и голубой цвет глаз; EYCL2 («bey1»), хромосома 15, кодирует карий цвет глаз, а EYC3 («bey2»), хромосома 15, отвечает за карий и голубой цвет глаз (Wikipedia, «Eye Color»). В целом за цвет глаз могут отвечать от 5 до 10 генов.
ASIP («agouti signaling protein»), хромосома 20. Аллель 8818G связана с более темным цветом кожи у африканцев и афроамериканцев. Поскольку она также найдена у африканских человекообразных обезьян, у африканцев она является предковой (Norton, 2006).
Здоровье и болезни
LCT («lactase gene»), хромосома 2, отвечает за синтез лактазы – фермента, катализирующего переваривание лактозы (молочного сахара). Аллель, позволяющая взрослым людям переваривать молочный сахар, возникла у жителей Северной Европы только недавно, между 5480 и 5000 г. до н. э. Аллель подвергалась тщательному эволюционному отбору, и ее носительство более чем у 90 % жителей Северной Европы может пролить свет на то, почему индоевропейцы оказались способными столь быстро расселиться по Европе около 4000 лет назад. Подавляющее большинство жителей Азии и Африки не имеют этого гена; тутси независимо приобрели аллель переносимости лактозы в более позднее время (Burger, 2007). Поскольку все дети могут переваривать лактозу, а большинство взрослых – нет, «способность переваривать лактозу может быть проявлением неотении» (Wikipedia, «Lactose Intolerance»).
CCR5 («chemokine (C–C motif) receptor 5»), хромосома 3. Делеция дельта-32 этого гена произошла более 5000 лет назад в Южной Финляндии и могла обеспечить некоторую защиту от натуральной оспы. Сегодня эта делеция имеется только у небольшого числа европейцев (1 %, хотя она присутствует у 10 % европейских евреев); она способствует их защите от вируса СПИДа (Zimmer, 2001, с. 222–225), но повышает риск заражения флавивирусами, такими как вирус лихорадки Западного Нила; у жителей Азии и Африки она не обнаруживается (Smith, 1997).
PDE4 («pyridoxine-dependent epilepsy»), хромосома 5. Аллель этого гена связана с риском заболевания ишемической болезнью сердца и раком легких. У чернокожих, выкуривающих до одной пачки сигарет в день, риск развития рака легких значительно выше, чем у белых, выкуривающих столько же сигарет. Возможно, чернокожие более склонны к раку легких, поскольку меньше подвергались воздействию дыма, так как в тропиках нет большой необходимости разводить огонь (Garte, 2001).
CYP3A5 («cytochrome»), хромосома 7, способствует задержке соли в почках. Часто встречается у африканцев, которые, живя в жарких условиях, теряют много соли при потоотделении. Нефункциональная аллель CYP3A5*3 значительно чаще встречается среди обитателей Евразии (у 96 % басков в Пиренеях), чем среди африканцев (у 6 % жителей Нигерии). Поэтому у африканцев, переселяющихся за пределы Африки, в организме задерживается слишком много соли, что ведет к сердечно-сосудистым заболеваниям. Другой ген, AGT M235, который также связан с задержкой соли, имеет сходное распространение (Thompson, 2004; Roy, 2005).
CASP12 («cysteinyl aspartate proteinase»), хромосома 9. Нефункциональная версия этого гена лучше защищает человека от сепсиса (бактериальной инфекции крови и тканей). Утрата функции произошла 51–74 тысячи лет назад (Wang X., 2006). Этот ген является функциональным у небольшой части африканцев, но не функционирует у жителей Евразии.
HBB («hemoglobin beta chain»), хромосома 11, кодирует бета-цепочку гемоглобина. Единственная копия аллели этого гена защищает против малярии, а наличие двух копий вызывает серповидно-клеточную анемию (Corballis, 1991, с. 95); чаще всего обнаруживается у людей, живущих в малярийных областях Африки и Индии.
CD4 («cell development»), хромосома 12. Вероятно, аллель 7R давно присутствовала у неандертальцев, но у Homo sapiens sapiens могла появиться только 30 000 лет назад. Является рецептором для ВИЧ (Hanna, 1989).
BRCA1 («breast cancer»), хромосома 17. Аллель этого гена связана с риском развития рака молочной железы. Среди евреев ашкенази каждая сороковая женщина является носительницей аллелей генов BRCA1 и BRCA2, что повышает для них вероятность рака молочной железы до 80 %.
LTA4H («leukotriene A4 hydrolase»), хромосома 17. Аллель этого гена повышает риск сердечных приступов у афроамериканцев более чем на 250 %, а у белых и монголоидов – только на 16 %. Этот ген повышает выраженность воспаления как средства защиты с инфекциями и в целом не обнаруживается у африканцев. Хотя аллель присутствует у 30 % белых, у них возникли другие гены с противоположным действием, а у 6 % афроамериканцев, приобретших ее в результате смешения с белыми, такие гены не появились (Helgadottir, 2006).
APOH («apolipoprotein H»), хромосома 17. Этот ген является главным аутоантигеном, вызывающим продукцию антифосфолипидных антител (АФА) при аутоиммунных заболеваниях. Аллель APOH*3B присутствует только у чернокожих и идентична животному типу APOH, имеющемуся у шимпанзе (Kamboh, 2004).
NOS2 («nitric oxide synthase»), хромосома 17, кодирует фермент, участвующий в образовании оксида азота. Аллель, присутствующая у африканцев в малярийных областях, вызывает повышенную продукцию оксида азота, что способствует защите от симптомов малярии. У европеоидов данной аллели нет (Keller, 2004).
CNDP1 («carnosine dipeptidase 1»), хромосома 18. Тринуклеотидная последовательность этого гена способствует защите европейцев, белых американцев и арабов, но не чернокожих, от терминальной стадии почечной недостаточности при сахарном диабете (Freedman B.I., 2007).
APOE («apolipoprotein E»), хромосома 19. Этот ген играет роль в транспорте холестерина и связан с развитием болезни Альцгеймера. Возможно, у некоторых людей вообще нет этого гена, и если это действительно так, здесь возникает ряд интересных вопросов (Miller, 2006).
Читатель мог заметить, что гены, отвечающие за один признак, могут влиять на другие признаки, кажущиеся не связанными с ним (например, PAX6, CCR5 и PAX6), и что некоторые аллели (предковые) обнаруживаются у чернокожих и шимпанзе, но не встречаются у других рас (NQ02, ASIP, APOH*3B, MC1R), а некоторые – наоборот (ASPM, MCPH1).
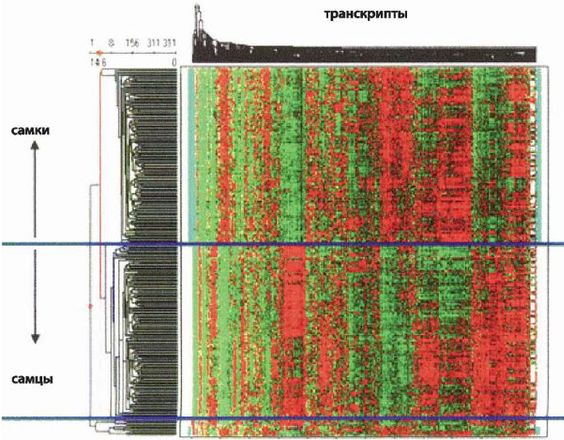
Рисунок 13-1
Мужчины и женщины отличаются друг от друга только одной хромосомой (Y у мужчин, X у женщин), но различия в этой хромосоме существенно влияют на их анатомию, физиологию и поведение. На рис. 13–1 (Yang, 2006) показано, как гены экспрессируются в печени самок и самцов мышей. Красный цвет указывает на большую экспрессию гена, зеленый – на меньшую. Можно было бы предполагать, что различия между самцами и самками должны ограничиваться разницей между X– и Y-хромосомами, имеющими отношение к воспроизведению потомства, однако эта карта показывает, что различия оказывают существенное влияние на гены, экспрессируемые в печени, которая к воспроизведению потомства отношения не имеет. Поэтому не стоит удивляться тому, что расовые различия в генах не только влияют на внешний вид, но значительно сильнее проявляются во внутренних особенностях организма. В настоящее время исследования генетики расовых различий сосредоточены главным образом на митохондриальной ДНК и кодирующей ядерной ДНК. В то же время у человека ДНК «замусорена» больше, чем у любого другого животного, а функции «мусорной» ДНК только начинают исследоваться. Можно ожидать, что важные расовые различия будут обнаружены и в этой ДНК, а также в ряде генных копий и генах-регуляторах – врожденных «переключателях», которые определяют, где и когда с гена должна считываться информация.
| <<< Назад Глава 12. Поведение |
Вперед >>> Глава 14. Интеллект |
- Когда я впервые начал чувствовать?
- Четыре волны богатства
- Мы и насекомые
- III. Если летишь в звездолете со скоростью, близкой к скорости света, какие ужасы ждут тебя по возвращении?
- По инерции
- Как чувствует наш мозг
- Трагическая история Армении
- Миф № 44 При браках между «далекими» расами не получается потомства! Поэтому расы – это разные виды!
- Рыбы, плотины и человек
- ГЛАВА 8 Чувство равновесия
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- Мир вирусов и переход от РНК к ДНК
