Книга: Удивительный мир органической химии
1.5. «...Она представляется мне дремучим лесом...»
| <<< Назад 1.4. Непохожие друг на друга |
Вперед >>> 1.6. О химическом строении тел |
1.5. «...Она представляется мне дремучим лесом...»
К началу второй половины XIX в. химики были знакомы со многими органическими соединениями. Правда, это были вещества главным образом природного происхождения. Химики их выделяли из растительных или животных организмов, из каменноугольной смолы, нефти и т. д. Они смело брались за установление состава этих соединений, за изучение их свойств. Для этого приходилось проводить много химических реакций, в которых органические вещества взаимодействовали с другими органическими веществами или, чаще, — с неорганическими. В результате было открыто много реакций, обнаружено немало закономерностей.
Это было время активных поисков и бесконечных экспериментов с органическими веществами.
Однако было и другое. Несмотря на то что еще не затих шум в химических кругах по поводу синтеза Ф. Вёлера, и еще свежи были в памяти случаи получения некоторых органических веществ из неорганических, и даже «жизненная сила» уже не казалась неприступной стеной, но, как это ни парадоксально, эти достижения органической химии представлялись многим как явление случайное и необычное. В работе химиков еще чувствовалась какая-то неуверенность, робость. К сожалению, это подкреплялось еще и тем, что редкие успехи химиков чередовались со многими неудачами и разочарованиями.
Конечно, для этого были веские причины. Но главной причиной было то, что отсутствовала точка опоры, от которой бы могли отталкиваться химики в своей работе. Такой опорой должна быть теория органической химии. К сожалению, такой теории еще не было, а без нее химики работали как бы на ощупь, в темноте, по интуиции. Конечно, существовали уже разработанные рецепты и правила работы со многими органическими веществами. Следуя им, иногда удавалось получить новый органический продукт, но какое он имеет строение и что это за вещество — химики не знали. И конечно же они не могли заранее планировать получение задуманного вещества. Не могли они и осуществить переход одного органического соединения в другое. Одним словом, это было время бесконечных проб и ошибок. О положении, в котором пребывали химики того времени, хорошо сказал Ф. Вёлер спустя десять лет после своего знаменитого синтеза. В письме к Й. Берцелиусу он с огорчением писал: «Органическая химия может в настоящее время кого угодно свести с ума... она представляется мне дремучим лесом, полным чудесных вещей; огромной чащей без выхода, без конца, куда не осмеливаешься проникнуть». Письмо датировано 1838 годом.
Но химики продолжали работать в своих лабораториях — больших и маленьких, светлых и погруженных в полуподвальный полумрак, теплых и сырых, продуваемых сквозняками, пропитанных едкими запахами всевозможных веществ.
И это время не прошло для них даром. Постоянно шло накопление опыта, экспериментального материала, который нуждался в осмысливании и систематизации. Эта трудоемкая работа приближала время, когда должна была родиться теория, которая могла бы не только помочь химикам объяснить строение органических соединений, но и позволила бы целенаправленно вести их синтез. Но, к сожалению, такой теории не было. Существовавшая теория «жизненной силы» не смогла взять на себя роль спасительницы. Да и она просуществовала недолго, хотя ее отголоски еще длительное время были слышны в химических лабораториях мира.
В это время некоторые химики стали замечать интересную особенность: группы из нескольких атомов (двух или более), оказывается, могут переходить без изменения из одной молекулы в другую. Такие группы получили название радикалов (от лат. radical — корень). Например, при получении из уксусной кислоты хлористого ацетила группа СН3СО (радикал ацетил) переходит неизмененной в новое вещество — хлористый ацетил:
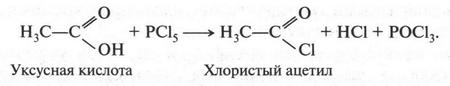
Й. Берцелиус, следивший внимательно за всем, что происходит в органической химии, сразу же обратил на это внимание. Он решил, что химики стоят на пороге открытия тайны строения органических веществ. Для этого, как надеялся ученый, необходимо лишь установить строение радикалов, а потом из них построить органические молекулы. Вот эта мысль и легла в основу «теории радикалов». В 1843 г. Й. Берцелиус даже сказал: «Органическая химия — это химия сложных радикалов». Ученый полагал, что все радикалы, входящие в молекулу, представляют собой противоположно заряженные частицы. Если это так, то силы, удерживающие атомы в органической молекуле (как и в неорганической), должны иметь одну природу — электрическую. Однако, как оказалось, это было верным только для неорганических веществ. Что же касается органических соединений, то многочисленные опыты уже в то время показали, что их растворы в большинстве своем не проводят электрический ток. Кроме того, согласно «теории радикалов» радикалы должны быть такими же прочными, как и атомы в неорганических веществах. Ведь Й. Берцелиус считал, что эти радикалы состоят только из атомов углерода и водорода (причем углерод якобы заряжен отрицательно, а водород — положительно). Но если это так, то любое замещение положительно заряженного водорода на отрицательно заряженный атом должно обязательно привести к резкому изменению свойств вещества. Но вскоре выяснилось, что такое утверждение ошибочно. Когда французский химик Огюст Лоран (1807-1853) заместил несколько атомов водорода в молекуле этилового спирта на атомы хлора, то оказалось, что такое замещение не вызвало значительного изменения свойств спирта. Это, конечно, противоречило этой теории. Ведь хлор считался отрицательно заряженным элементом, а водород — положительно заряженным. Но углерод, который считали элементом отрицательным, не мог соединиться с отрицательным хлором. При этом два атома, заряженные отрицательно, должны не соединяться, а отталкиваться! Через три года Ж. Дюма провел такую же реакцию замещения, но уже с уксусной кислотой{Впервые хлоруксусные кислоты получил Ловиц Товий Егорович (Иоганн Тобиас) в 1793 г.}. Прохлорировав ее, он получил хлоруксусную кислоту, которая, как оказалось, практически не отличалась от уксусной кислоты, но была более сильной.
Все эти факты противоречили «теории радикалов». Да и большинство химиков уже охладели к этой теории.
Итак, вывод Й. Берцелиуса о том, что органические радикалы могут служить своеобразными «кирпичиками», из которых построены органические вещества, оказался несостоятельным.
Прошло не так уж много времени, и на смену ушедшей теории пришла новая — теория типов. Она была предложена и развита О. Лораном, который отстаивал свою точку зрения, несмотря на авторитет Й. Берцелиуса. В своей теории О. Лоран утверждал обратное: органическая молекула представляет единое целое, а не состоит из противоположно заряженных частиц. Сторонники этой теории представляли молекулу в виде ядра, к которому присоединены различные радикалы. Поэтому органические молекулы можно сгруппировать в отдельные типы («семейства»). Вначале были предложены четыре таких типа:

Чем привлекала эта теория? Все казалось очень простым и ясным. Например, в молекуле воды («тип воды») к центральному атому кислорода («ядру») присоединены два атома водорода. Замещая один из них на различные радикалы, можно получить целое «семейство» органических соединений. Так, при замещении одного из водородных атомов на метальный (СН3) или этильный (С2Н5) радикал образуются соответственно два спирта — метиловый и этиловый.

(В скобках приведено современное написание формул метилового и этилового спиртов.)
В результате такого замещения атома водорода на различные радикалы можно получить (вывести) многочисленный ряд спиртов. Но не только спиртов. Легко построить органические соединения, относящиеся, например, к классу простых эфиров:

Позже немецкий химик Фридрих Август Кекуле (1829-1896), исходя из четырехвалентности атома углерода, предложил еще один тип — «тип метана»:

Как видите, «теория типов» позволила наглядно записывать химические формулы органических соединений, которые с формальной точки зрения были близки к современной записи. Появилась, как надеялись химики, удобная классификация органических соединений. В этом отношении «теория типов» сыграла, конечно, положительную роль. Поэтому она завоевала большую популярность среди химиков.
Но полностью удовлетворить химиков эта теория также не могла. Она по-прежнему исходила из того, что органические соединения построены из радикалов. В то же время главный вопрос — вопрос о внутреннем строении молекул — обходился стороной. Даже расположение атомов в самих радикалах оставалось неясным. Правда, пока химики имели дело с более или менее простыми веществами, эта теория еще могла «работать». Но с появлением более сложных веществ началась путаница. Например, хлоруксусную кислоту пришлось отнести сразу к двум типам — к «типу воды» и «типу хлороводорода»:
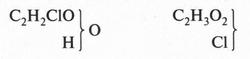
Даже соединение, имеющее формулу С2Н6 (этан), вызвало затруднение. Так, согласно «типу водорода», это вещество должно существовать в виде двух продуктов:
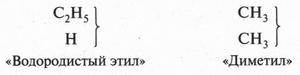
Сейчас известно, что формула С2Н6 выражает собой газ — этан, у которого изомеров нет.
Все это происходило потому, что в те далекие времена химики еще долго считали формулы веществ лишь средством, позволяющим только изображать превращения веществ, но не строение их молекул. Они даже одному и тому же веществу часто приписывали несколько формул. Например, А. Кекуле в своем учебнике по органической химии (1861) приводил для уксусной кислоты два десятка формул!
Действительно, в трудном положении оказались химики в начале второй половины XIX в.!
| <<< Назад 1.4. Непохожие друг на друга |
Вперед >>> 1.6. О химическом строении тел |
- Межклеточное вещество
- 04. На что влияет нагрев планет звездами, звезд Ядрами Галактик, Ядер Галактик Ядрами Сверхгалактик
- Список литературы
- Разные человечества
- Красные тучи, закрывающие солнце
- Московская белая
- Муравей, семья, колония
- Примерные рационы для котят от месяца до пяти и старше
- Голосеменные растения завоевывают мир
- Пароль скрещенных антенн
- Позор страны
- Что такое водопад?
