Книга: Удивительный мир органической химии
1.7. Как нарисовать молекулу
| <<< Назад 1.6. О химическом строении тел |
Вперед >>> 1.8. Изомер означает «равный» |
1.7. Как нарисовать молекулу
Можно ли нарисовать молекулу на бумаге? Такой вопрос задавали химики еще в середине XIX в. Они пытались это сделать, но такие попытки, конечно, были безуспешными.
Теперь нам понятны причины этих неудач. Для того чтобы изобразить молекулу на листке бумаги, необходимо было знать строение органических веществ.
Для решения этой проблемы много сделали химики, развивая учение о валентности химических элементов. Напомним, что валентность химического элемента — это свойство его атомов присоединять определенное число атомов других элементов. Поскольку углерод является основой всех органических соединений, то установление его четырехвалентности было важным моментом для объяснения строения этих веществ. Как известно, идеи о четырехвалентности атома углерода высказал А. Купер еще в 1858 г. При этом он считал, что углеродные атомы могут соединяться друг с другом (правда, эта мысль была уже не новой; ее высказал Фридрих Рохледер еще в 1852 г.). Однако этого было, конечно, недостаточно. Для построения даже простейшей (эмпирической) формулы химического вещества необходимо было знать его качественный и количественный состав. Известно, что многие органические соединения состоят из углерода, водорода и кислорода. Определив содержание этих элементов, уже можно было установить эмпирическую формулу соединения. Правда, в отличие от веществ неорганических, с органическими соединениями дело обстояло сложнее, так как последние отличались большим содержанием атомов в молекуле. Например, долго велись дискуссии по поводу эмпирической формулы уксусной кислоты, которая оказалась не такой уж и сложной (С2Н4O2). Но как бы там ни было, к тому времени удалось установить формулы для 2-3 десятков органических соединений, в том числе и для некоторых простых сахаров.
Однако эмпирические формулы, показывающие, какие элементы и в каком количестве входят в состав органического вещества, мало говорят о его строении. Для этого нужны другие формулы — формулы строения. Такие формулы называют структурными формулами.
Согласно представлениям А. Кекуле, А. Купера и А. М. Бутлерова, углеродные атомы могут соединяться друг с другом с помощью одной или нескольких из четырех своих валентных связей, образуя длинные углеродные цепи — прямые или разветвленные. Поскольку у каждого атома углерода имеются четыре валентные связи, а у каждого атома водорода — только одна такая связь, можно изобразить три формулы простейших предельных углеводородов — метана СН4, этана С2Н6 и пропана С3Н8 следующим образом:
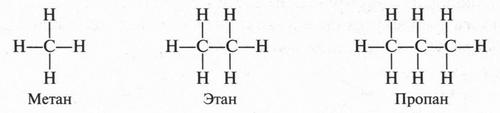
В молекуле метана атомы водорода связаны с атомом углерода, а не друг с другом. Это и понятно. Если допустить, что водородные атомы соединены не с углеродным атомом, а между собой, то тогда они, исчерпав на это по единственной валентности, не смогли бы соединиться с атомом углерода. В результате образовались бы две молекулы водорода, а не молекула метана. Рассмотрим молекулу этана. В этой молекуле два атома углерода связаны между собой, а каждый из них — с тремя водородными атомами. Возможно ли другое соединение атомов? Нет. В противном случае мы должны допустить существование таких структур:
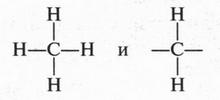
Такие структуры соответствуют молекуле метана и частице, у которой атом углерода имеет две свободные валентности, но такая частица будет очень неустойчивой. Значит, существует другая возможность соединения атомов в молекуле этана: два углеродных атома соединены между собой, а с ними атомы водорода. Такой же порядок соединения атомов мы видим в молекуле пропана и в других углеводородах.
Увеличивая число атомов углерода, можно продолжить вывод формул следующих за пропаном углеводородов — бутана (С4Н10), пентана (С5Н12), гексана (С6Н14) и т. д.
Если добавить к углеводородной цепи атом кислорода (имеющего две валентные связи) или атом азота (с тремя валентными связями), то можно написать структурные формулы молекул этилового спирта (С2Н5ОН) и метиламина (CH3NH2):
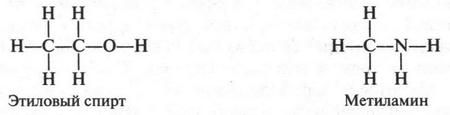
Структурные формулы, как вы видите, наглядно показывают последовательность соединения между собой атомов в молекуле. Такое соединение происходит с учетом валентности и химических свойств атомов.
Если же в молекулах органических соединений содержатся двойные или тройные связи, то их изображают так:
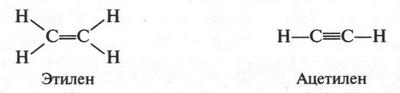
Как видите, простая (одинарная) связь изображается одной черточкой, двойная — двумя, а тройная — тремя. Число черточек у элемента соответствует его валентности. Обычно структурные формулы записывают в более сокращенном виде, например:
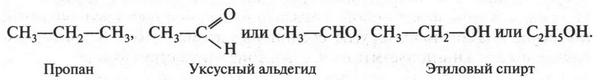
Если же изображают циклические соединения, то в их формулах символы атомов углерода и водорода можно не обозначать, но их присутствие обязательно подразумевается:

Полезность структурных формул была настолько очевидной, что многие химики приняли их сразу. Они стали отказываться от изображения органических молекул в виде нагромождений из радикалов. Сам А. М. Бутлеров широко использовал структурные формулы в своей работе. Более того, начиная с 60-х гг. XIX в. он убедительно показывал, как с помощью структурных формул можно наглядно объяснить причины существования изомеров.
В то же время нельзя забывать и о том, что любая, даже очень удачная структурная формула — всего лишь абстрактный образ молекулы. Она не является точным отображением реальной структуры и конечно же не может выразить полностью свойства органической молекулы. Формула лишь показывает расположение атомов в молекуле. Это означает, что нельзя отождествлять символ молекулы — формулу — с ее реальной «фотографией».
| <<< Назад 1.6. О химическом строении тел |
Вперед >>> 1.8. Изомер означает «равный» |
- 8.22. КАК «ВЫРАСТИТЬ» ОРГАНИЧЕСКУЮ МОЛЕКУЛУ?
- § 14. Химические явления. Горение
- Особенности репликации бактериальной ДНК
- Неземная гравитация
- ГЛАВА 28 Зачем пища должна быть вскусной?
- Дуньхуан – начало или конец Великой стены?
- Мертвая хватка Платона
- Сноски из книги
- Исаак Ньютон (1643–1727)
- После обезьян были «Адам» и «Ева»
- 7. Органические вещества. Общая характеристика. Липиды
- Чудеса аравийских пустынь
