Книга: Удивительный мир органической химии
1.4. Непохожие друг на друга
| <<< Назад 1.3. Свыше десяти миллионов! |
Вперед >>> 1.5. «...Она представляется мне дремучим лесом...» |
1.4. Непохожие друг на друга
Чем же отличаются органические вещества от неорганических?
Чтобы ответить на этот вопрос, проделаем очень простой опыт. Нагреем несколько кристаллов органического вещества. Даже при сравнительно невысокой температуре они начинают плавиться и переходят в жидкое состояние. Если температуру еще повысить, то эта жидкость начинает пениться (кипеть), а потом разлагаться, сгорать или обугливаться. Например, если сухую деревянную палочку внести в огонь, то она, постепенно обугливаясь, сгорает и переходит в тлеющие угли. Проделаем еще такой опыт. Возьмем пинцетом кусочек сахара и внесем его в пламя горелки. Вначале из сахара выделяются газы, затем он обугливается и сгорает.
Если охладить продукты, которые получились от сгорания палочки и сахара, то в них вы не узнаете прежние предметы.
А теперь поступим иначе. Внесем в пламя любое неорганическое вещество, например хлорид натрия. Вы увидите, что соль ведет себя совсем иначе, чем палочка и кусочек сахара. Соль выдерживает даже очень высокую температуру. Она вначале растрескивается на мелкие кусочки, а потом, если бы удалось повысить температуру до 800 °С, начинает плавиться. При 1440 °С расплавленная соль закипает. Но стоит расплавленную соль охладить, как получается тот же продукт, что был вначале. Эта соль опять пригодна для приготовления пищи!
Есть еще одно отличие между органическими и неорганическими веществами. Известно, что большинство неорганических веществ хорошо растворимо в воде. В то же время органических веществ, которые растворяются в воде, не так уж и много. Почему?
Чтобы ответить на этот вопрос, необходимо рассмотреть, как связаны между собой атомы в молекулах неорганических и органических веществ.
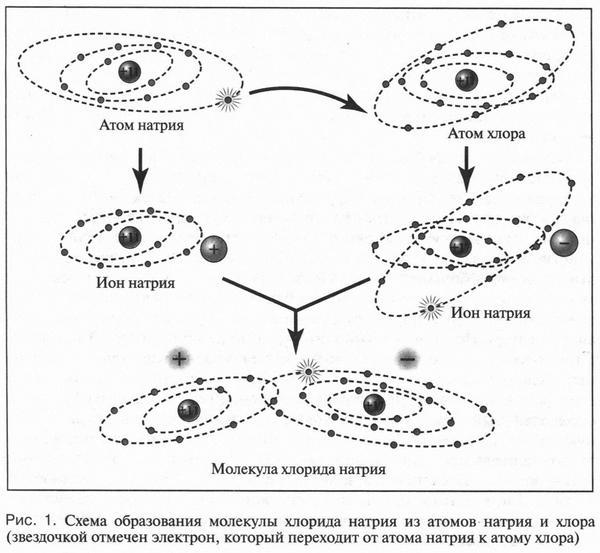
Известно, что любой атом состоит из положительно заряженного ядра, в котором сосредоточена практически вся масса атома, и отрицательно заряженных электронов, окружающих это ядро. Электроны располагаются от ядра на различных расстояниях. Группы электронов, удаленные на одинаковое расстояние от ядра и обладающие одинаковой энергией, образуют слои (оболочки). Чем дальше от ядра расположены эти слои, тем большей энергией обладают их электроны. Поскольку атом — нейтральная частица, то это означает полную компенсацию положительного заряда ядра отрицательным зарядом всех электронов, входящих в атом. Но иногда такой компенсации не происходит. Это связано с тем, что число электронов в атоме может изменяться: при определенных условиях атом способен присоединять или отдавать несколько электронов. Если атом принимает электроны, то возникает избыточный отрицательный заряд и нейтральный атом превращается в отрицательную частицу — анион. Если же атом отдает электроны, то преобладает положительный заряд ядра и образуется положительно заряженный ион — катион. Поясним это на примере образования молекулы хлорида натрия. Атом натрия при взаимодействии с атомом хлора отдает ему единственный электрон, который расположен на внешнем электронном слое. В результате у атома натрия остаются 10 электронов (всего же было 11 электронов), а у атома хлора их будет уже 18 (было 17) (рис. 1). Так как терять и приобретать электроны могут только внешние электронные слои атомов, то на этих слоях у атомов натрия и хлора остается по восемь электронов, как у инертных газов (неона, аргона и др.). Следовательно, эти слои приобретают устойчивую электронную конфигурацию. Итак, вместо нейтрального атома натрия образовался катион, а атом хлора превратился в противоположную частицу — анион. Поскольку разноименные заряды, как известно, притягиваются, то из ионов образуется молекула хлорида натрия. Связь между катионом и анионом хлора называется ионной. Молекулы, имеющие ионную связь, всегда полярны, так как в них в одной области группируются положительные заряды, а в другой — отрицательные. Теперь посмотрим, что же происходит при растворении полярной молекулы хлорида натрия в воде.
Сразу же напомним, что в молекуле воды также преобладает ионная связь. Когда же полярные молекулы воды приближаются к полярным молекулам хлорида натрия, то происходит ориентация этих молекул друг относительно друга. Они располагаются так, что к катиону натрия и аниону хлора подходят молекулы воды с противоположным знаком. В результате между молекулами воды и хлорида натрия возникает притяжение. Затем молекулы воды внедряются между ионами хлорида натрия, ослабляют связь между ними и «растаскивают» ионы натрия и хлора в разные стороны. Вот так происходит процесс растворения неорганических веществ.
Совсем по-другому протекает растворение органических соединений. Это и неудивительно. Ведь химическая связь между атомами в органических соединениях совсем другая, чем в неорганических. Если ионная связь образуется между атомами, которые способны отдавать и присоединять электроны (как в случае атомов натрия и хлора), то химическая связь в органических веществах соединяет такие атомы, которые такой способностью не обладают. Тогда как же соединяются эти атомы?
В этом случае все происходит гораздо проще. Атомы, вступающие в химическую связь, не теряют и не присоединяют электроны, они их... «обобществляют», т. е. делают общими для двух атомов. Например, в случае образования молекул хлора или водорода такой процесс можно изобразить так:
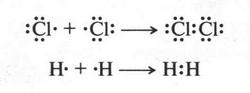
На этих схемах точками изображены электроны наружных слоев. Две точки между атомами в молекуле обозначают электронные пары, состоящие из «обобществленных» электронов. Эти электроны в одинаковой мере принадлежат сразу обоим атомам. Химическая связь, осуществляемая электронными парами, называется ковалентной связью. Такая связь является основной химической связью для органических соединений.
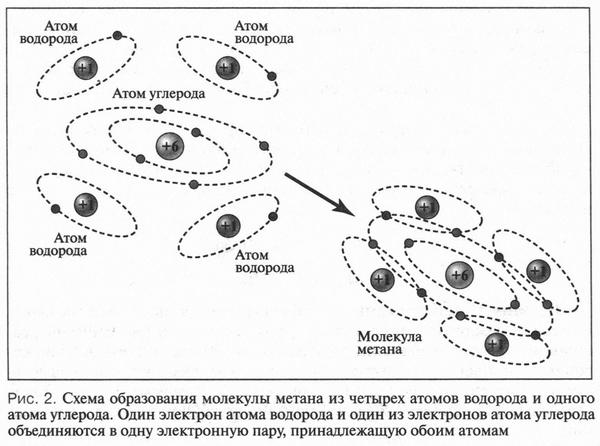
Рассмотрим образование ковалентных связей в самом простом органическом веществе — метане. Его молекула состоит из одного атома углерода и четырех атомов водорода, т. е. его эмпирическая формула будет СН4. Поскольку на внешней электронной оболочке углеродного атома находятся четыре валентных электрона, то он способен образовать четыре ковалентные связи С—Н. Эти связи образуются за счет «обобществления» четырех электронов атома углерода и четырех электронов атомов водорода (по одному от каждого атома) (рис. 2). В результате во внешнем электронном слое атома углерода будет находиться восемь электронов (как у инертного газа неона), а у каждого атома водорода — два (как у инертного газа гелия). Поэтому формула молекулы метана с четырьмя электронными парами будет выглядеть так:
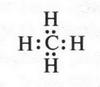
Электронную пару обычно изображают в виде одной черточки. Эта черточка обозначает простую (одинарную) химическую связь.
Следующий за метаном углеводород — этан С2Н6 — содержит семь электронных пар:
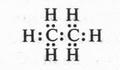
Однако не следует забывать, что на самом деле каждому атому принадлежит только половина образовавшейся электронной пары!
Итак, молекулы органических соединений, в отличие от неорганических, построены не из ионов, а из нейтральных атомов. Поэтому полярные молекулы воды с органическими молекулами взаимодействовать, как в случае хлорида натрия, не будут. Они отскакивают от них, как от стенки горох. Вода — основной растворитель для неорганических веществ — в мире органической химии уступает таким растворителям, как спирт, бензол, эфир и др. Тут подтверждается старое химическое правило: «подобное растворяется в подобном». Но даже и в этих растворителях органические вещества будут распадаться на отдельные молекулы, а не на ионы. Например, при растворении сахара в воде в сладком растворе будут находиться только молекулы этого органического вещества. Правда, есть и такие органические соединения, которые не только растворяются в воде, но и образуют в ней ионы. Примером могут служить карбоновые кислоты, соли и др. Вот как образуются ионы уксусной кислоты при ее диссоциации:
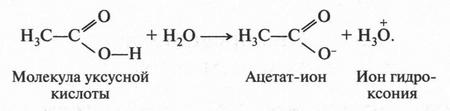
Однако таких соединений в органической химии не так уж и много. Но даже и в этом случае ионный заряд возникает не на атоме углерода, а на кислородном атоме. Это означает, что разорвалась не углерод-водородная связь, а кислород-водородная.
Химики давно заметили, что при проведении химических реакций скорость взаимодействия между неорганическими веществами намного больше, чем между органическими. Попробуйте, соблюдая осторожность, смешать раствор гидроксида натрия (едкого натра) с соляной кислотой. Реакция в этом случае протекает мгновенно и бурно с выделением теплоты. Это — обычная реакция нейтрализации:
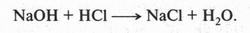
Почему же такая высокая скорость? Это объясняется тем, что щелочь и кислота находятся в виде ионов, реакционная способность которых очень велика. Органические же вещества, как мы знаем, ионов практически не образуют. Поэтому реакции между ними протекают медленно. Более того, часто для полного завершения органической реакции приходится ждать несколько часов, а то и суток. Иногда химики применяют особые вещества — катализаторы, которые ускоряют реакцию. Очень часто реакционную смесь приходится нагревать или проводить реакцию даже под давлением.
Итак, органические вещества имеют свои особенности. Но это не означает, что между органическими и неорганическими веществами нужно возвести высокую стену. Те и другие могут быть получены одним и тем же химиком в одной и той же лаборатории. Конечно, в органической химии есть свои особенности, свои «тайны», как и в любой другой науке. Да, она не похожа на неорганическую химию, но от этого не стала труднее для изучения. Более того, органическая химия имеет более стройную систему, чем химия неорганическая. В течение почти двух веков химики-органики умудрились так расположить все сведения об органической химии, что эта наука стала необычайно стройной и логически завершенной. Этому способствует и то, что в органических соединениях практически все элементы, входящие в их состав, имеют постоянную валентность.
| <<< Назад 1.3. Свыше десяти миллионов! |
Вперед >>> 1.5. «...Она представляется мне дремучим лесом...» |
- Магнитары, Великолепная семерка и все-все-все – новый зоопарк нейтронных звезд
- 867. Ведется ли в настоящее время промышленная разработка марганцевых конкреций?
- КОЭВОЛЮЦИЯ
- Семантическое управление через Игры
- 4. Развитие общинного образа жизни у муравьев
- 642. Есть ли в океане бактерии?
- 8. Микроорганизмы и сельское хозяйство
- Бегом... по воде
- 9.5. Выбор брачного партнера
- На какие отряды разделяется класс млекопитающих
- Часть 2 Технологический конструктор
- Закадычные враги
