Книга: Удивительный мир органической химии
1.8. Изомер означает «равный»
| <<< Назад 1.7. Как нарисовать молекулу |
Вперед >>> Глава 2 Углеродный атом — он самый главный |
1.8. Изомер означает «равный»
В органической химии существует очень интересное явление — изомерия. Это явление известно химикам давно. Так, в 1822 г. Ф. Вёлер открыл циановую кислоту и установил ее эмпирическую формулу (CHNO). Через год другой химик — Ю. Либих, изучая гремучую кислоту, был крайне удивлен, когда обнаружил, что она имеет тот же состав, что и циановая кислота. Однако эти вещества резко отличались по свойствам. Итак, одинаковый состав, но разные свойства. Было чему удивляться! Й. Берцелиус, узнав об этом факте, не сразу поверил ему. Но уже в 1830 г. сам столкнулся с таким же явлением. Он обнаружил, что две органические кислоты — виноградная и винная — хотя и обладают разными свойствами, но имеют одну и ту же эмпирическую формулу — С4Н6O6. Поскольку содержание элементов в этих соединениях было одинаковым, Й. Берцелиус назвал такие вещества изомерами, а само явление — изомерией. Это греческое слово в переводе обозначает «равные части». Таким образом, циановая и гремучая кислоты — изомеры. Изомерами являются виноградная и винная кислоты.
Число открытых изомеров быстро росло, и это явление нуждалось в объяснении. На правильном пути к ответу на этот вопрос были Й. Берцелиус, а затем и Ж. Дюма. Они рассуждали так: если две молекулы построены из одинакового числа одних и тех же атомов, но обладают различными свойствами, то причина тут одна — различное распределение атомов в молекуле. Но как понимать и чем объяснить это различное распределение? На этот главный вопрос они ответить не могли.
Потребовалось почти три десятилетия, чтобы явление изомерии получило научное объяснение. Это сделал А. М. Бутлеров в своей теории строения органических соединений. Это было ярким примером удивительного предвидения. Например, до 1861 г. было известно лишь одно вещество состава С4Н10 — бутан. Его формулу изображают в виде прямой цепочки.
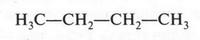
Однако ученый высказал предположение о том, что должно существовать еще одно соединение с такой же эмпирической формулой, но с другой последовательностью соединения углеродных атомов в молекуле.
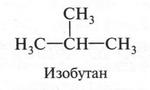
Такое вещество А. М. Бутлеров назвал изобутаном (приставка «изо» обозначает разветвление). Ученый не только предложил метод получения этого вещества, но и получил его. Это было первым убедительным доказательством справедливости теории А. М. Бутлерова.
Итак, если в молекуле четыре атома углерода, то они могут образовать только два вида (изомера) молекул — н-бутан и изобутан (н — означает «нормальный», т. е. неразветвленный). Если же количество углеродных атомов увеличить, то возрастет и число их возможных расположений, т. е. число изомеров.
Рассмотрим изомерию углеводорода с шестью углеродными атомами — С6Н14. Сколько же у него изомеров?
Вначале изобразим строение молекулы самого простого соединения — н-гексана. Его формула будет такой.
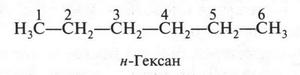
В этой молекуле атомы углерода связаны друг с другом без разветвления. Теперь «разорвем» связь между первым и вторым углеродными атомами, а отделившуюся метальную группу (СН3) «присоединим» к третьему углеродному атому. В результате получится такая формула.
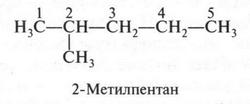
Это — второй изомер. Он имеет ответвление при втором углеродном атоме. Если это ответвление «перенести» на третий углеродный атом, то получим третий изомер.
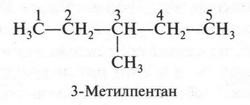
А теперь поступим так: в третьем изомере «разорвем» связь между первым и вторым углеродными атомами, а образовавшуюся метильную группу «присоединим» к третьему углеродному атому. Это — четвертый изомер, у которого главная цепь стала еще короче.
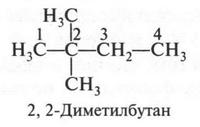
В этом изомере со вторым углеродным атомом связаны три метильные группы. Если же метальную группу «присоединим» не ко второму углеродному атому (как мы поступили, образуя четвертый изомер), а к третьему, то получим пятый изомер.
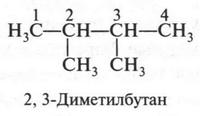
Итак, углеводород состава С6Н14 имеет пять изомеров: один — нормальный (т. е. неразветвленный) и четыре — разветвленные. Других изомеров у этого углеводорода нет.
Отличаются ли эти изомеры по химическим и физическим свойствам? По химическим — практически нет, а по физическим — отличаются. Так, бутан кипит при — 0,5 °С, а изобутан — при — 11,4 °С. Точки кипения изомеров углеводорода С6Н14 равны соответственно: 68, 60,3, 63,3, 49,7 и 58 °С. Интересно, что температуры кипения изомеров разветвленного строения имеют более низкие значения, чем нормального строения. Все это является доказательством того, что строение молекулы определяет свойства вещества. Это является одним из основных положений теории А. М. Бутлерова.
Число изомеров очень быстро растет с увеличением числа углеродных атомов в молекуле. Например, у углеводорода С10Н22 изомеров 75, а у С20Н42 число возможных изомеров достигает 366 319, у С30Н62 их уже 4 111 846 763, а для соединения С40Н82 изомеров более 60 триллионов!
Химики, конечно, не ставят себе целью получить все эти изомеры. Это просто невозможно, да и в этом нет необходимости. Подавляющее большинство изомеров, особенно с большим числом углеродных атомов, имеют лишь теоретический интерес. Поэтому многие из них существуют пока только на бумаге. Однако некоторые изомеры все же получены. Так, вначале были синтезированы все изомеры пентана (С5Н12). Синтез всех изомерных гептанов (С7Н16) был завершен позже — в 1929 г., изомерных октанов (С8Н18) — к 1933 г., а изомерных нонанов (С9Н20) — только к 1946 г. Что же касается высших углеводородов, то для них были получены только по несколько изомеров.
Необходимо сказать о том, что при выводе изомерных формул нельзя принимать искривление формулы за появление нового изомера. Например, формулы
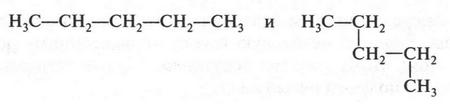
выражают одно и то же вещество — пентан.
Кстати, выводить изомерные формулы на бумаге легко, а вот получать изомерные вещества в лаборатории — совсем другое дело! Это очень трудная работа.
Итак, мы познакомились с самым простым видом изомерии — структурной изомерией, или изомерией углеродной цепи. В этом случае, как мы видим, изомеры отличаются друг от друга только строением цепи, состоящей из углеродных атомов. Однако в органической химии су-шествуют и другие, более сложные виды изомерии. Посмотрите на формулы этих соединений:
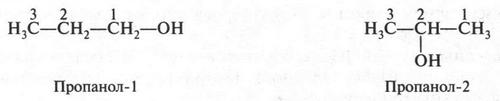
Эти формулы выражают строение двух изомерных спиртов. В первом из них (пропанол-1) гидроксильная группа (—ОН) связана с первым углеродным атомом, во втором (пропанол-2) — со вторым. Такой вид изомерии называется изомерией положения. Помните, мы говорили о двух изомерных кислотах — гремучей и циановой? А теперь посмотрите на их структурные формулы.

В гремучей кислоте гидроксильная группа связана с атомом азота, а в циановой кислоте — с атомом углерода. Это тоже изомерия положения. Однако и гремучая кислота, и циановая кислота имеют одну и ту же эмпирическую формулу (CHNO), несмотря на то что они различаются по химическим свойствам.
А вот еще пример изомерии положения. Известно, что у этилового спирта и диметилового эфира одна и та же эмпирическая формула — С2Н6O. Однако структурные формулы этих соединений совершенно разные.
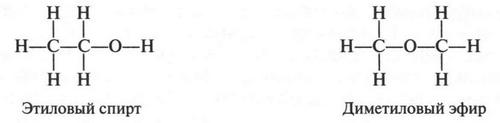
Действительно, в формуле этилового спирта один из шести атомов водорода присоединен к кислородному атому, а в формуле диметилового эфира все шесть водородных атомов связаны с атомами углерода. Да и атом кислорода в одном случае связан с одним углеродным атомом, во втором — находится между двумя углеродными атомами. Поэтому неудивительно, что в различном расположении атомов кроется проявление разных свойств этих соединений. Так, оказалось, что атом кислорода удерживает водородный атом слабее, чем углеродный атом. Поэтому металлический натрий, добавленный к этиловому спирту, легко замещает водород, связанный с атомом кислорода. В то же время натрий, добавленный к диметиловому эфиру, водород не вытесняет. Вот вам еще пример подтверждения теории А. М. Бутлерова: строение молекулы определяет свойства вещества.
Интересный случай изомерии положения у непредельных соединений с двойной связью (алкенов). Например, для соединения С4Н8 (бутен) возможны три изомера.
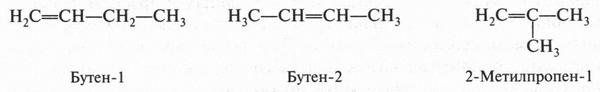
Первые два изомера (с неразветвленной углеродной цепью) отличаются между собой положением двойной связи в цепи, а третий — характером цепи (разветвлением). Таким образом, для алкенов возможны два типа изомерии: изомерия, связанная с положением двойной связи в цепи, и изомерия углеродной цепи (как у алканов). Однако для алкенов возможен еще один вид изомерии — геометрическая (цис-, транс-) изомерия. Однако этот вид изомерии мы рассмотрим позже, когда подробно рассмотрим строение двойной связи.
| <<< Назад 1.7. Как нарисовать молекулу |
Вперед >>> Глава 2 Углеродный атом — он самый главный |
- Равенство не означает одинаковость
- 17. Что означает латинское выражение «Mare Liberum»?
- 63. Что означает масштаб карты?
- 380. Что означает нынешняя тенденция к потеплению?
- 41. Что означает часто встречающееся в океанографии выражение «in situ»?
- 18. Откуда возникло выражение «право мирного прохода» и что оно означает?
- Глава 13 Буквой с обозначается скорость света в пустоте
- Откуда появилось и что означает слово «космос»?
- 2.3. Что означает расширение Вселенной?
- Что означает ожог первой, второй и третьей степени?
- 3.33. ЧТО ОЗНАЧАЕТ НАЗВАНИЕ «РОДАНИДЫ»?
