Книга: Жизнь замечательных веществ
1.4. Уголь, сера, нитрат натрия, хлорат калия и не только
| <<< Назад 1.3. Карбонат лития |
Вперед >>> 1.5. Фуллерены – еще одна разновидность углерода |
1.4. Уголь, сера, нитрат натрия, хлорат калия и не только

Как говорит народная мудрость, огонь – одна из тех трёх вещей, на которые можно смотреть бесконечно. Пламя пробуждает наши страхи и мечты, огонь говорит с нами на языке, появившемся прежде наших слов и мыслей. Куда бы мы ни торопились, ни летели по делам, языки огня, будь то горящий камин, костёр в лесу или фейерверк, привлекают наше внимание и завораживают нас.
Магия огня объективна – она породила не только человеческую цивилизацию, но и привела к появлению человека разумного. С того момента, когда наши далёкие предки начали жарить пищу на кострах, её потребление позволило древним человекообразным существам тратить меньше времени на пережевывание и переваривание сырых продуктов. У них оставалось больше времени и энергии на другие занятия (к примеру, на общение), а снижение энергетических затрат на расщепление термически обработанной еды позволило перенаправить ресурсы организма на другие биохимические процессы, что в конечном итоге привело к росту мозга и биологическому эволюционированию нашей нервной системы. Так, благодаря огню появилась жизнь человека разумного.

Благодаря огню появилась и химия – когда-то первобытные люди поняли, что можно не собирать «огненный цветок» на месте природных пожаров, а разводить огонь самостоятельно, высекая камушками искры в сухую листву и кострище. Ещё чуть позже, методом проб и ошибок или просто в результате случайной находки, было обнаружено, что если посыпать на топливо для костра чёрный порошок, который можно получить, растирая какие-то тёмные камни, огонь разводится гораздо легче: при раскопках стоянок неандертальцев археологи обнаружили подвергавшиеся трению куски оксида марганца с повышенным содержанием диоксида марганца. Сейчас нам известно, что если присыпать MnO2 к дровам и сухой лучине, то температура их воспламенения понизится примерно на 100 °C. Конечно, ни про температуру возгорания, ни про диоксид марганца неандертальцы ничего не знали, но поскольку причинно-следственную связь между обработкой дров порошком пиролюзита и легкостью разведения костра им все же удалось найти (Sci. Rep., 2016, DOI: 10.1038/srep22159), первыми химиками-технологами вполне можно считать неандертальцев.

Итак, огню нужно топливо и окислитель. Для разведения пламени необходимо инициирование – искра, которую можно получить трением. Тепло вспышки инициирует реакцию горения – взаимодействие топлива с окислителем, и далее экзотермическая реакция идет сама собой. Кажется, что всё просто, но детали этого процесса остаются тайной даже и для современной науки.
Шли годы, огонь помогал человеку и строить цивилизации, и разрушать их. В какой-то момент (снова методом проб и ошибок) было обнаружено, что поддерживать горение может не только кислород воздуха, и для огненного цветка можно использовать твердый окислитель. Опять же это было сделано задолго до открытия кислорода и кислородной теории горения, равно как и до появления первых представлений о процессах окисления и восстановления. Китайские алхимики получили горючий состав, в котором топливом служили уголь и сера, а окислителем – селитра. При горении этого состава выделяющееся тепло способствует разложению селитры и высвобождению кислорода, который ускоряет горение. Горючий состав стал не просто гореть, а взрываться, и появился порох. Воины Поднебесной использовали порох в военных кампаниях в качестве зажигательной смеси, для снаряжения первых ракет, которые, пугая лошадей, расстраивали ряды кавалерии противника и наносили вред легкой пехоте, а также для изготовления предтечей современного ружья – «копий яростного огня». Последнее оружие представляло собой бамбуковую трубку, закрытую с одного конца и открытую с другого. В трубку сначала насыпали порох, а потом немного круглых камешков.
Европейцы не мелочились на ручное вооружение, и европейский «открыватель» пороха монах Бертольд Шварц (в миру – Константин Анклитцен) сразу же изобрел пороховую артиллерию. По легенде, Шварц растирал в ступке куски серы, селитры и древесного угля и получил черный порошок, который взорвался, выбросив всё содержимое ступки, которая при этом раскололась. Дальнейшие эксперименты показали, что если что-то, похожее на ступку, но размером побольше, изготовить не из керамики, а из бронзы, оно не разрушается взрывом, а вот содержимое бросает на вполне хорошее расстояние. Так на вооружении венецианцев, а потом и других европейских армий появились первые пороховые артиллерийские системы – мортиры, получившие название в честь погибшей при эксперименте Шварца ступки (ступка по латыни – mortarium).

Изобретение порохового оружия перевернуло военное дело: не только перекроило карты Старого и Нового Света – об этом написано столько книг, что только одно перечисление их заглавий займет не одну книгу, но и, что более важно, породило новый тип химиков-технологов, даже химиков-биотехнологов, которые финансировались за счет государственной казны.
Когда мы слышим про биотехнологию, нам в голову приходят образы сверкающих реакторов из нержавеющей стали, специалистов в белоснежных халатах, пипетки, шприцы и управляемые компьютерами процессы, протекающие в безукоризненно чистых лабораториях. Вряд ли мы думаем о лопатах, ржавых котлах в человеческий рост, моче и навозе. Тем не менее именно этими инструментами работали со своими реагентами селитрянщики – химики-биотехнологи, оплата труда которых шла из государственного бюджета.
Возможно, современных химиков это сравнение может и покоробить, однако именно с селитрянщиков начиналась спонсируемая государством химическая промышленность. Презираемые нанимателями и дворянством, но, тем не менее, хорошо организованные отряды селитрянщиков были ужасом крестьян XVI–XVII веков – с дозволения Короны или парламента они перерывали хлева, конюшни, а иногда и отхожие места, собирая селитру или нитрат калия KNO3.
Из трех компонентов дымного пороха селитра оказалась самым редким. Если в те времена леса покрывали большую часть Европы, в сырье для производства древесного угля недостатка не было, серу добывали во многих, в том числе и европейских государствах, то вот селитра была завозным товаром, который импортировался в государства Северной или Западной Европы из Южной Европы и Азии. Одним из основных экспортеров нитрата калия была Индия, отсюда его несколько более позднее название – «индийская селитра».

Появление и повышение значения огнестрельного оружия приводило к зависимости боеспособности армий от привозного сырья, что не могло не беспокоить королей и парламенты таких стран, как, например, Франция, Англия и Швеция, и поэтому стратегия импортозамещения селитры своими местными источниками вскоре стала одним из приоритетных направлений военно-экономической политики государств Европы.
Вскоре после того, как было обнаружено (опять же, скорее всего – случайно), что если прокипятить в большом количестве воды верхний слой почвы стойла, отфильтровать воду от твердых остатков жизнедеятельности животных, а затем добавить к раствору поташ, то из кипящего котла можно выделить белые кристаллы селитры, королевские дома и парламенты Европы организовали целую сеть концессий селитрянщиков, работа которых регламентировалась соответствующими ордонансами. Единственными аналитическими инструментами селитрянщиков были их интуиция и вкусовые сосочки их языков. Без сомнения, для работы этим химикам, трудившимся на военно-промышленный комплекс стран и княжеств эпохи Возрождения, требовались недюжинные умения и опыт.
Хотя разорение амбаров и добыча стратегических ресурсов для селитрянщиков было весьма прибыльным делом, крестьяне, чьи постройки подвергались регулярным налетам, не получали никакой компенсации. Чтобы отвадить «химиков с большой дороги» от своих построек, сообразительные фермеры начали мостить полы в хлевах. Твердое напольное покрытие портило лопаты селитрянщиков. Эта практика распространилась широко, но селитра стоила столь дорого, что в странах, испытывающих наибольший её дефицит, – Англии и Швеции, практика постройки помещений для скота с твердым напольным покрытием была объявлена вне закона. Король Швеции Густав I Васа так вообще объявил, что земля в шведских конюшнях и коровниках является собственностью Короны.
Интенсивность переработки продуктов жизнедеятельности крупного рогатого скота в компоненты чёрного пороха немного снизилась после Великих географических открытий – в Новом Свете были найдены залежи нитрата натрия (чилийской селитры), но всё равно изготовление чёрного пороха оставалось недешёвым, и воюющие армии почти всегда испытывали его дефицит. Так, свидетельства участников Испанской кампании Наполеона (с британской стороны) часто говорят о том, что, успешно отбив обоз противника, солдаты, даже находившиеся в крайней степени истощения, первоначально наполняли пороховницы и набирали порох про запас, а только потом набрасывались на еду.
Спустя некоторое время после изобретения и потери репутации «дьявольского порошка» порох, конечно, использовался не только для штурмов и осад, он находил применение и в исключительно мирных целях – для фейерверков, но было это крайне редко. Во-первых, всё же было чрезмерным расточительством расходовать стратегическое сырье на развлечение горожан и изнеженных аристократов, и разумные правители это понимали. Во-вторых, горящий и взрывающийся порох отвратительно пах диоксидом серы, и далеко не все утонченные и изнеженные аристократы могли выдержать этот запах. В-третьих, поскольку при разложении нитратов выделяется сравнительно мало кислорода что на единицу количества вещества, что на единицу массы, горение пороха не давало достаточной энергии для ионизации металлов, придающих окраску пламени современной пиротехники, и пороховые фейерверки были однообразно скучного желтого цвета.
Яркие краски в «развлекательных взрывах» появились благодаря работам Луи Бертолле, а бертолетова соль (хлорат калия KClO3) стала первым окислителем не нитратной природы, который стали добавлять в пиротехнические составы. Впервые это вещество французский химик получил в 1786 году, пропуская хлор через горячий концентрированный раствор гидроксида калия: 6KOH + 3Cl2 – KClO3 + 5KCl + 3H2O. При охлаждении раствора был получен белый осадок (при низких температурах бертолетова соль растворяется в воде гораздо хуже других солей калия). Большее в сравнении с селитрами количество кислорода, выделяемое бертолетовой солью при нагревании, обеспечивает более интенсивное горение топлива, энергии которого хватает для возбуждения металлов и окраски их ионами пламени. Сейчас, создавая фейерверки, специалисты подбирают такие химические компоненты, которые при вспышке дают определенные цвета. Соли бария, например, окрашивают пламя в зелёные цвета, соли меди – в зелёные и голубые, соли натрия – в жёлтые. Литий дает красные тона, магний при горении выделяет сверкающий белый цвет, а стронций – искрящийся красный.
Работы Бертолле привели не только к тому, что фейерверки заиграли новыми красками (хотя и к этому тоже). Благодаря новым подходам к химии горения и окисления ученые получили возможность определения металлов по цвету их пламени (о, эти знакомые со школьных учебников карминово-красный, малиново-красный и кирпично-красный цвета) – сначала качественного, а потом, с развитием метода атомно-адсорбционного анализа, – и количественного.
В наши дни бертолетова соль практически не используется в создании пиротехнических составов по соображениям безопасности – она чересчур реакционноспособна. Так, смесь бертолетовой соли с серой небезопасна уже своей экстраординарной чувствительностью к трению, и она была запрещена в Британии еще в XIX веке. В настоящее время окислителем для пиротехники являются более стабильные и, следовательно, менее опасные перхлораты калия KClO4 и аммония NH4ClO4.
С работ Бертолле и появления огневых составов, предназначенных исключительно для несмертельного использования, появился и термин «пиротехника», который в современной интерпретации звучит так: «Пиротехника представляет собой смесь материалов, способных к сгоранию с определённым эффектом при подходящем способе инициирования». В большинстве случаев современные пиротехнические составы состоят из топлива, окислителя и связующего, дающего составу структурное однообразие. Иногда к пиротехническим составам добавляют дополнительные вещества, придающие составу особые свойства. Топлива пиротехнических составов должны сгорать с большим экзотермическим эффектом, и поэтому чаще всего в качестве топлив используются простые вещества-металлы (алюминий, хром, магний, марганец, титан) и простые вещества-неметаллы (бор, кремний, сера). Окислителями в большинстве пиротехнических составов являются перхлораты и нитраты (органические и неорганические), реже – хлораты, хроматы и пероксиды. И, наконец, связующие в пиротехнике могут быть как природного (пчелиный воск, шеллак, отвержденное льняное масло), так и искусственного происхождения (полихлорвинил, бакелит, хлорированные каучуки и полиэфирные смолы).
Так как помимо фейерверков в ведении современной пиротехники находятся ещё и автомобильные подушки безопасности, ракетное топливо, сигнальные ракеты военного и гражданского назначения, конкретная область применения того или иного состава диктует необходимость введения добавок, отвечающих либо за увеличение объема продуктов сгорания, либо за особо яркое и окрашенное пламя. Есть добавки, которые отвечают за звуковые сигналы (многие помнят анекдот про сигнал, который подается «тремя зелёными свистками»), есть добавки, позволяющие пиротехническим составам давать густой и устойчивый сигнальный дым или дымовую завесу. Естественно, что при взрыве пиротехнического изделия высвобождается целый «коктейль» ядовитых соединений, опасных для человека и для окружающей среды: тяжелые металлы, хлораты и диоксины, аэрозоли дымов, моноксид углерода, оксиды серы (Angew. Chem. Int. Ed, 2008, DOI: 10.1002/anie.200704510).

В связи с необходимостью создания новых пиротехнических составов, способных демонстрировать новые «спецэффекты», а также для решения вопросов защиты окружающей среды в наши дни ситуация с химией и пиротехникой изменилась. Если где-то до середины XIX века открытие нового взрывчатого вещества или состава с новым цветом пламени влекло за собой новые открытия в химии и других естественных науках и пиротехника была одним из локомотивов химического прогресса, то сейчас мы имеем дело с обратной ситуацией – наши представления о строении и свойствах веществ, наши знания о химии теперь применяются для рационального создания пиротехнических составов, в первую очередь оказывающих минимальное воздействие на состояние окружающей среды.
Очевидно, что одним из способов решения экологических проблем, связанных с применением пиротехники, является простая оптимизация её горения, исключающая образование продуктов неполного сгорания. В идеале необходимо, чтобы пиротехника при срабатывании не образовывала неполных продуктов сгорания, и единственными веществами, образовавшимися во вспышке, были вода и диоксид углерода, до которых должны окислиться органические вещества, входящие в состав, а также оксиды металлов (MgO, Al2O3), если топливом состава является металл. Способность пиротехнического состава к полному сгоранию за счёт «внутренних ресурсов» окислителя выражается таким его параметром, как кислородный баланс. Кислородный баланс взрывчатого вещества или пиротехнической смеси является положительным, если общего количества связанного кислорода, входящего в их состав, хватает до полного сгорания смеси до углекислого газа, воды и оксидов металлов, и кислород даже остается в избытке и выделяется в виде простого вещества. Если же входящего в состав пиротехники кислорода не хватает до образования продуктов полного сгорания, а продуктам сгорания неполного приходится догорать в кислороде атмосферном, мы говорим про отрицательный кислородный баланс.
Гипотетически можно предположить и существование нулевого кислородного баланса (весь кислород пиротехнического состава ушел на его полное сгорание, и избыточного кислорода не осталось), но подгадать так точно на практике едва ли удается. К тому же, если учесть, что при формовании петард и прочей пиротехники равномерного перемешивания окислителя, связующего и топлива не всегда удается добиться, существует возможность того, что даже пиротехнические изделия одной партии могут незначительно отличаться по составу. Памятуя об этом, производители пиротехники там, где это возможно, стараются выдерживать положительный кислородный баланс. Для органического вещества, состоящего только из углерода, водорода, азота и кислорода состава CaHbNcOd, кислородный баланс вычисляется по формуле:
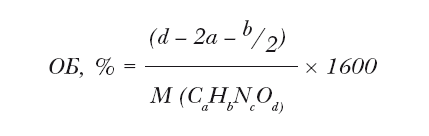
Ещё в XIX веке выяснив опытным путем, что нитросоединения взрываются, и тем громче, чем больше в их структуре содержится нитрогрупп, и отработав методологию получения органических соединений, содержащих нитро– и нитратогруппы, исследователи отправились в поход за получением новых органических нитросоединений, которые сразу после разработки технологии их получения становились и взрывчатыми веществами, и окислителями в пиротехнике.
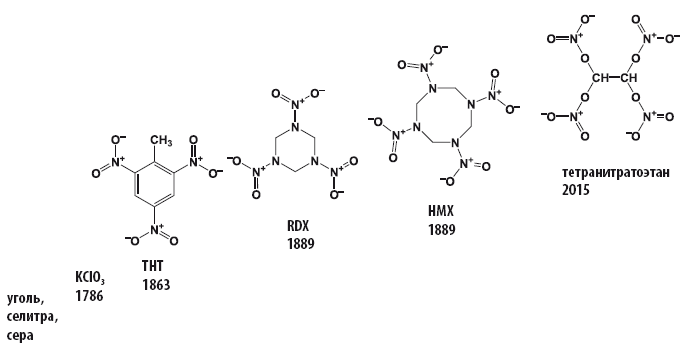
За 150 лет содержание кислорода в органических взрывчатых веществах, способных выступать в качестве окислителей, выросло с 42,3 до 70.1 %.
Началось все относительно скромно – с обладающего отрицательным кислородным балансом (–74 %) тринитротолуола, содержание кислорода в котором составляет 42,3 %. Со временем количество групп – NO2 или – NO3 увеличивалось, и последний рекорд по содержанию кислорода и кислородному балансу для органического соединения был поставлен в 2015 году (Chem. Commun., 2016, 52, 916; DOI: 10.1039/c5cc09010e).

Исследователи из Мюнхенского технического университета, работающие в группе Томаса Клапотке (Thomas Klap?tke), сообщили о синтезе, протекающем в соответствии с достаточно простым протоколом, исключительно богатого кислородом тетранитратэтана (C2H2N4O12). Исследование, в результате которого удалось получить новый тип твердого окислителя, является частью международного проекта по получению новых окислителей, способных заменить токсичный перхлорат аммония.
Тетранитратэтан, полученный в лаборатории, не только отличается наиболее высоким содержанием кислорода по сравнению с известными в настоящее время твердыми окислителями, но и представляет собой весьма редкий пример соединения, в котором с одним атомом углерода одновременно связано больше одной богатой кислородом нитрато-группы – O–NO2.

C содержанием кислорода, равным 70,1 %, и кислородным балансом, составляющим 40,9 %, тетранитратэтан мог бы рассматриваться как перспективный окислитель. Расчёты эффективности его применения как окислителя в процессах горения, моделирующих горение ракетного топлива, позволяют говорить о том, что смеси топливо/тетранитратэтан эффективнее смесей топливо/перхлорат аммония и многих других.
Клапотке и его коллеги пока ещё сомневаются в возможности практического применения своего детища: тетранитратэтан отличается низкой термической устойчивостью, при нагревании разлагается со взрывом, он чувствителен к трению и толчкам и способен к самопроизвольному разложению со взрывом (с другой стороны, все эти свойства присущи и чистому нитроглицерину, «взрывной характер» которого всё же методом проб и ошибок был укрощен).
Ещё одно направление повышения экологической чистоты пиротехники – разработка добавок, которые бы позволили снизить нежелательные выбросы продуктов горения пиротехники в окружающую среду. Первыми кандидатами на замену оказались хлорид меди (компонент синих огней) и соединения бария, дающие пламени зелёную окраску.
Обычно пиротехнические составы, дающие светло-голубое пламя, получают, используя металлическую медь или медьсодержащие вещества в комбинации с источником хлора. Принцип действия составов основан на том, что при высокой температуре хлор реагирует с медью с образованием хлорида меди (I). Другими способами получить полноценное голубое пламя очень сложно. Тот же Томас Клапотке в соавторстве с Джессом Сабатини (Jesse Sabatini), работающим в подразделении пиротехнических составов армии США, смог получить не содержащую хлор смесь химических веществ, которая горит светло-голубым пламенем (Angew. Chem. Int. Ed., 2014, doi: 10.1002/anie.201405195) и представляет собой практичную альтернативу обычным составам для фейерверков и сигнальных огней.
Новая пиротехническая смесь содержит йодид меди (I), который отличается значительной эмиссией в голубой области видимого спектра. Помимо того что CuI экологичнее существующих пиротехнических составов, новая смесь отличается большей спектральной чистотой, чем традиционные комбинации веществ, которые применяются в пиротехнике.
Работая уже без Клапотке, Джесс Сабатини выяснил, как получить зелёные во всех смыслах пиротехнические составы. Он обнаружил, что при использовании в фейерверках карбида бора получается такая же эффективная зелёная окраска, какую дают применяющиеся в настоящее время в пиротехнических составах производные бария (Angew. Chem. Int. Edn., 2011; doi:10.1002/anie.201007827).
Работа Сабатини началась с того, что он получил от армии США заказ на разработку дешёвой, не содержащей бария альтернативы ручной сигнальной ракете зелёного пламени M125A1, основой состава которой является смесь нитрата бария с поливинилхлоридом. Эта смесь горит зелёным пламенем с образованием хлорида бария.
В поисках кандидатов на новый пиротехнический состав без бария и хлора исследователи обратили внимание на бор. Порошок аморфного бора сгорает зелёным пламенем с образованием оксида бора, однако сгорание аморфного бора происходит слишком быстро, чтобы применять его в пиротехнических составах. Исследователи обнаружили, что скорость горения можно замедлить, добавив к бору аморфному другую аллотропную модификацию – бор кристаллический, но кристаллический бор слишком дорог.
Как отмечает Сабатини, исследователям казалось, что они находятся на грани прорыва, и они решили провести скрининг «экзотических» производных бора. В ставших уже классикой химических статьях 1950-х – 60-х годов Сабатини с соавторами обнаружили информацию о том, что отличающийся крайней химической инертностью при комнатной температуре карбид бора проявляет значительную химическую активность при повышенной температуре. Введение значительных количеств карбида бора в аморфный бор значительно увеличило время горения пиротехнического состава, но, более того, исследователи с удивлением обнаружили, что наиболее эффективным временем горения отличается чистый карбид бора. Не меньшее удивление вызвали эти результаты и у коллеги Сабатини по пиротехнике. Клапотке высоко оценил его работу, отметив, что именно химическая инертность карбида бора в своё время привела к тому, что это соединение не рассматривали как возможный компонент для пиротехнических составов.
Пиротехники ХХI века не обошли вниманием и такой тип взрывчатых веществ, как инициирующие взрывчатые вещества. Основным инициирующим веществом для детонаторов в боеприпасах в настоящее время является токсичный азид свинца.
В наибольшей степени вредное влияние «капсюльного» свинца на окружающую среду проявляется на армейских стрельбищах, где свинец из инициирующих взрывчатых веществ попадает в окружающую среду десятилетиями, из-за чего его концентрация на этих местах приблизилась к критическому уровню, и военнослужащие, равно как и гражданский персонал, обеспечивающий работу стрельбища, регулярно подвергаются воздействию свинца. Инициирующие взрывчатые вещества на основе азида свинца применяются в военных и полицейских боеприпасах, а также в детонаторах, которые применяются в ходе горных разработок. Только в США ежегодно производится около 10 миллионов тонн устройств, содержащих азид свинца, при этом из-за их использования в окружающую среду ежегодно попадает около 350 килограммов свинца.
Инициирующие взрывчатые вещества требуют осторожного обращения не только из-за легкости их детонации, но и из-за того, что свинец, входящий в состав двух наиболее распространенных инициирующих взрывчатых веществ – азида и тринитрорезорцината, отличается высокой токсичностью, канцеро– и тератогенностью, а долговременное использование этих материалов может привести к существенному загрязнению окружающей среды.
Клапотке удалось подобрать ключи к созданию экологически чистых инициирующих ВВ – он с коллегами разработал первичное взрывчатое вещество, не содержащее свинец или другие опасные для окружающей среды тяжелые металлы (Angew. Chem. Int. Ed., 2014, DOI: 10.1002/anie.201404790).
Единственный металл, присутствующий в новом веществе, которое бабахает, – 1,1'-динитрамино-5,5'-бистетразоляте калия (K2DNABT) – это калий, безопасный как с точки зрения токсикологии человека, так и потенциального урона окружающей среде. Клапотке также добавляет, что в соответствии с результатами лабораторных испытаний новое взрывчатое вещество устойчиво по отношению к ударам, трению и статическому электричеству примерно в такой же степени, как и азид свинца. Ещё одним направлением увеличения экологичности фейерверков и пиротехники является замена сгорающего с образованием целого букета вредной хлорорганики полихлорвинила на менее опасные связующие материалы. В качестве возможной замены рассматриваются даже столь популярные в настоящее время металлоорганические каркасные структуры (Chem. Comm., 2015, DOI: 10.1039/c5cc04174k).
За века и тысячелетия человек приручил огонь, сделал его управляемым, расцветил «огненный цветок» почти всеми цветами радуги, делая его менее опасным и для себя, и для окружающей среды. Сложно сказать, как будет эволюционировать химия взрывчатых веществ и пиротехнических составов далее, но об одном точно можно было бы мечтать: чтобы вся современная пиротехника применялась исключительно для того, чтобы радовать глаз людей на фейерверках, и для решения только мирных задач, – не хотелось бы, чтобы огонь, создавший человеческую цивилизацию и самого человека, послужил бы её разрушению.
| <<< Назад 1.3. Карбонат лития |
Вперед >>> 1.5. Фуллерены – еще одна разновидность углерода |
- 1.1. Соляная кислота
- 1.2. Мел или карбонат кальция
- 1.3. Карбонат лития
- 1.4. Уголь, сера, нитрат натрия, хлорат калия и не только
- 1.5. Фуллерены – еще одна разновидность углерода
- 1.6. Циановодород
- 1.7. Озон
- 1.8. Угарный газ, который не стоит путать с веселящим
- 1.9. Веселящий газ, который не надо путать с угарным
- 1.10. Ртуть
- 1.11. Диоксид титана
- 1.12. Ультрамарин
- 1.13. Берлинская лазурь
- 1.14. Гексафторид урана
- 1.15. Мочевина
- 1.16. Что чем пахнет
- 96. Важнейшие окислители и восстановители.
- 120. Получение и применение галогенов.
- 122. Кислородсодержащие соединения галогенов.
- Металл красных огней
- У большинства женщин нет чувства юмора
- Если вы неактивны, вы остаетесь неактивны
- Сравнение свойств географической карты и плана местности. План местности. Географическая карта
- Сноски из книги
- 9.39. БЕРТОЛЛЕ И СПИЧКИ
- Меньше, чем лютеция
- Изотоп в тупике
