Книга: Общая химия
217. Бор (Borum).
| <<< Назад Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ |
Вперед >>> 218. Алюминий (Aluminium). |
217. Бор (Borum).
Бор сравнительно мало распространен в природе; общее содержание его в земной коре составляет около 10-3% (масс.).
К главным природным соединениям бора относятся борная кислота H3BO3 и соли борных кислот, из которых наиболее известна бура Na2B4O7·10H2O.
Хотя бор расположен в третьей группе периодической системы, он по своим свойствам наиболее сходен не с другими элементами этой группы, а с элементом четвертой группы — кремнием. В этом проявляется «диагональное сходство», уже отмечавшееся при рассмотрении бериллия.
- 610 -
Так, бор, подобно кремнию, образует слабые кислоты, не проявляющие амфотерных свойств, тогда как Al(OH)3 — амфотерное основание. Соединения бора и кремния с водородом, в отличие от твердого гидрида алюминия, — летучие вещества, самопроизвольно воспламеняющиеся на воздухе. Как и кремний, бор образует соединения с металлами, многие из которых отличаются большой твердостью и высокими температурами плавления.
Свободный бор получают восстановлением борного ангидрида B2O3 магнием. При этом бор выделяется в виде аморфного порошка, загрязненного примесями. Чистый кристаллический бор получают термическим разложением или восстановлением его галогенидов, а также разложением водородных соединений бора. Он имеет черный цвет и среди простых веществ по твердости уступает только алмазу.
Природный бор состоит из двух стабильных изотопов: 10B и 11B. Первый из них сильно поглощает медленные нейтроны. Поэтому бор и его соединения применяются в ядерной технике. Из них изготовляют регулирующие стержни реакторов, а также используют их в качестве материалов, защищающих от нейтронного облучения.
В металлургии бор применяется как добавка к стали и к некоторым цветным сплавам. Присадка очень небольших количеств бора уменьшает размер зерна, что приводит к улучшению механических свойств сплавов. Применяется также поверхностное насыщение стальных изделий бором — борирование, повышающее твердость и стойкость против коррозии.
Вода не действует на бор; концентрированные же серная и азотная кислоты окисляют его в борную кислоту. Например:
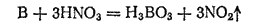
При комнатной температуре бор соединяется только с фтором, на воздухе он не окисляется. Если нагреть аморфный бор до 700°C, то он загорается и горит красноватым пламенем, превращаясь в оксид; при этом выделяется большое количество теплоты:
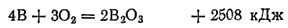
При высокой температуре бор соединяется со многими металлами, образуя бориды, например, борид магния Mg3B2. Многие бориды очень тверды и химически устойчивы, причем сохраняют эти свойства при высоких температурах. Для них характерна также тугоплавкость. Например, борид циркония ZrB2 плавится при 3040°C. Благодаря таким свойствам бориды некоторых металлов применяются для изготовления деталей реактивных двигателей и лопаток газовых турбин.
При накаливании смеси бора с углем образуется карбид бора B4C. Это тугоплавкое вещество (темп, плавл. около 2350°C), обладающее очень высокой твердостью и химической стойкостью.
- 611 -
Карбид бора применяется для обработки твердых сплавов; его механические свойства сохраняются при высоких температурах.
С галогенами бор также реагирует при нагревании и образует вещества общей формулы BГ3. Как уже было показано на примере BF3 (см. стр. 131), в этих соединениях бор находится в состоянии sp2-гибридизаиии, образуя с галогенами плоские молекулы с углами между связями Г—В—Г, равными 120°.
Галогениды бора, как и другие соединения бора неполимерного строения, являются электронодефицитными (см. стр. 590). Так, в молекуле фторида бора во внешнем электронном слое атома бора находятся всего шесть электронов:
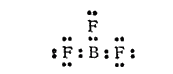
В этом состоянии атом бора может, следовательно, быть акцептором электронной пары. Действительно, BF3 соединяется по донорно-акцепторпому способу с водой, аммиаком и другими веществами; известен также комплексный анион BF4-. Во всех подобных соединениях ковалентность и координационное число бора равны четырем, а атом бора находится в состоянии гибридизации sp3 и образует тетраэдрические структуры.
Бороводороды (бораны). При действии соляной кислоты на борид магния Mg3B2 получается сложная смесь различных бороводородов, анлогичных угле- и кремневодородам. Из этой смеси выделены в чистом виде следующие бороводороды:
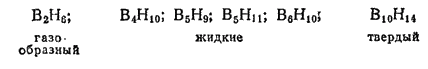
Главным продуктом взаимодействия борида магния с соляной кислотой является тетраборан B4H10 — летучая жидкость (темп, кип. 18°C) с очень неприятным запахом, пары которой воспламеняются на воздухе. При хранении тетраборан постепенно разлагается с образованием простейшего из полученных бороводородов — диборана B2H6. Последний представляет собой газ, конденсирующийся в жидкость при -92.5°C. На воздухе он не загорается, но водой, как и другие бороводороды, тотчас же разлагается с отщеплением водорода и образованием борной кислоты H3BO3:
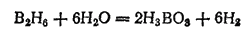
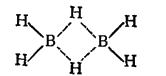
Атомы бора в молекулах бороводородов связаны друг с другом водородными «мостиками», например:
- 612 -
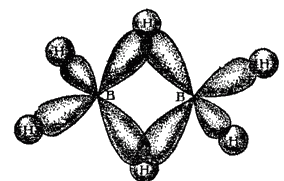
Рис. 164. Перекрывание атомных орбиталей в молекуле диборана.
Пунктиром на этой схеме показаны трехцентровые связи: здесь общая пара электронов занимает молекулярную орбиталь, охватывающую три атома — «мостиковый» атом водорода и оба атома бора. Такая орбиталь образуется вследствие перекрывания ls-орбитали атома водорода с sp3-гибридными орбиталями двух атомов бора (см. рис. 164). Четыре «концевых» атома водорода связаны с атомами бора обычными двухцентровыми двухэлектронными связями. Таким образом, из двенадцати валентных электронов, имеющихся в атомах, составляющих молекулу диборана. восемь участвуют в образовании двухцентровых связей B-H, а четыре образуют две трехцентровые связи В—Н—В.
Наибольшее практическое значение имеют кислородные соединения бора.
Оксид бора, или борный ангидрид, B2O3 может быть получен или путем непосредственного соединения бора с кислородом, или прокаливанием борной кислоты. Это бесцветная хрупкая стекловидная масса, плавящаяся при температуре около 300°C. Борный ангидрид очень огнестоек и не восстанавливается углем даже при белом калении. В воде он растворяется с образованием борной кислоты и выделением теплоты:
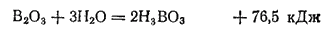
Борная, или ортоборная, кислота H3BO3 представляет собой белые кристаллы, блестящие чешуйки которых растворяются в горячей воде. Борная кислота может быть получена действием серной кислоты на горячий раствор тетрабората натрия Na2B4O7:
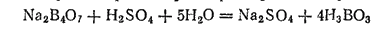
При охлаждении раствора борная кислота выкристаллизовывается, так как в холодной воде она малорастворима.
При кипячении раствора борной кислоты вместе с парами воды отчасти улетучивается и борная кислота. Этим объясняется ее содержание в водяных парах, выделяющихся из трещин земли в вулканических местностях.
Борная кислота принадлежит к числу очень слабых кислот (при 20°C K1=6·10-10; K2=2·10-18; K3=2·10-14; ).
При нагревании борная кислота теряет воду, переходя сначала в метаборную кислоту HBO2, а затем в борный ангидрид B2O3. Применяется борная кислота при приготовлении эмалей и глазурей, в производстве специальных сортов стекла, в бумажном и кожевенном производстве и в качестве дезинфицирующего средства.
Соли борных кислот — бораты — большей частью являются производными не ортоборной кислоты H3BO3, а четырехборной H2B4O7 и других более бедных водой борных кислот.
- 613 -
Тетраборат натрия, или бура, образует большие бесцветные прозрачные кристаллы состава Na2B4O7·10H2O, которые в сухом воздухе легко выветриваются. Бура получается при взаимодействии борной кислоты с гидроксидом натрия:
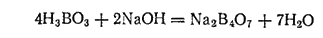
Водные растворы буры вследствие гидролиза обладают сильнощелочной реакцией.
При нагревании бура теряет кристаллизационную воду и плавится. В расплавленном состоянии она растворяет оксиды различных металлов с образованием двойных солей метаборной кислоты, из которых многие окрашены в цвета, характерные для каждого металла. На этом свойстве буры основано ее применение при сварке, резании и паянии металлов. Бура широко применяется в производстве легкоплавкой глазури для фаянсовых и фарфоровых изделий и особенно для чугунной посуды (эмаль). Кроме того, она используется при изготовлении специальных сортов стекла и в качестве удобрения, поскольку бор в малых количествах необходим растениям.
| <<< Назад Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ |
Вперед >>> 218. Алюминий (Aluminium). |
