Книга: Общая химия
222. Актиноиды.
| <<< Назад 221. Лантаноиды. |
Вперед >>> Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП |
222. Актиноиды.
К семейству актиноидов принадлежат четырнадцать f-элементов, следующих в периодической системе после актиния:
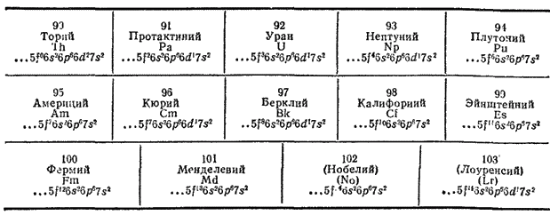
Как и в случае лантаноидов, у элементов семейства актиноидов происходит заполнение третьего снаружи электронного слоя (подуровня 5f); строение же наружного и, как правило, предшествующего электронных слоев остается неизменным. Это служит причиной близости химических свойств актиноидов. Однако различие в энергетическом состоянии электронов, занимающих 5f- и 6d-подуровни в атомах актиноидов, еще меньше, чем соответствующая разность энергий в атомах лантаноидов. Поэтому у первых членов семейства актиноидов 5f-электроны легко переходят на подуровень 6d и могут принимать участие в образовании химических связей. В результате от тория до урана наиболее характерная степень окисленности элементов возрастает от +4 до +6 . При дальнейшем продвижении по ряду актиноидов происходит энергетическая стабилизация 5f-состояния, а возбуждение электронов на 6й-подуровень требует большей затраты энергии. Вследствие этого от урана до кюрия наиболее характерная степень окисленности элементов понижается от +6 до +3 (хотя для нептуния и плутония получены соединения со степенью окисленности этих элементов +6 и +7).
- 624 -
Берклий и следующие за ним элементы во всех своих соединениях находятся в степени окисленности +3.
Все актиноиды радиоактивны. Торий, протактиний и уран встречаются в природе, так как у них имеются изотопы с большим периодом полураспада. В ничтожных количествах находятся в природе нептуний и плутоний. Остальные актиноиды получены искусственным путем в течение последних 30 лет (см. § 37).
Несмотря на неустойчивость атомов актиноидов, первые семь элементов этого семейства получаются в значительных количествах в свободном состоянии и в виде различных соединений - оксидов, галогенидов и др.
Гидроксиды актиноидов Э(OH)3 имеют основной характер. Отвечающие им соли по своей растворимости сходны с соответствующими солями лантаноидов.
Торий содержится в земной коре в количестве около 10-3% (масс.). Его минералы всегда сопутствуют редкоземельным элементам, урану и некоторым другим металлам. Важнейший промышленный источник тория — минерал монацит.
В свободном состоянии торий — серебристо-белый тугоплавкий пластичный металл. Степень окисленности тория в соединениях обычно равна +4, важнейший его оксид — ThO2.
Торий применяется в ядерной технике. Под действием нейтронов природный торий, состоящий почти нацело из изотопа 232Th, превращается в изотоп урана 233U, который служит ядерным горючим (см. стр. 108). Кроме того, торий применяется как легирующий компонент ряда сплавов. В частности, сплавы на основе магния, содержащие тории, цинк, цирконий и марганец, отличаются малой плотностью, высокой прочностью и химической стойкостью при высоких температурах.
Уран открыт в 1789 г., но в чистом виде (металл серо-стального цвета) выделен только в 1841 г. Содержание его в земной коре оценивается в 3·10-4 (масс.), что соответствует общему количеству 1,3·1014 металла. Природные соединения урана многообразны; важнейшими минералами являются уранинит (диоксид урана UO2), настиран (фаза переменного состава UO2,0-2,6) и карнотит (уранил-ванадат калия K2(UO2)2·(VO4)2·3H2O). Руды урана обычно содержат не более 0,5% полезного минерала.
Природный уран состоит из трех радиоактивных изотопов: 238U (около 99,3%) и 235U (около 0,07%) и 234U(около 0,005%). Периоды полураспада их соответственно равны 4,5·109 лет, 7·108 лет и 2,5·105 лет.
Важнейшее свойство урана состоит в том, что ядра некоторых его изотопов способны к делению при захвате нейтронов; при этом выделяется громадное количество энергии. Это свойство урана используется в ядерных реакторах, служащих источниками энергии, а также лежит в основе действия атомной бомбы (см. § 37). Непосредственно для получения ядерной энергии применяются изотопы 235U и 233U.
- 625 -
Из них 235U применяется в виде природного урана, обогащенного этим изотопом. Важнейший метод обогащения (или выделения) изотопа основан на различии в скорости диффузии газообразных соединений изотопов через пористые перегородки. В качестве газообразного соединения урана используют его гексафторид UF6 (температура сублимации 56,5°C). Из изотопа 238U получают изотоп плутония 239Pu, который также может использоваться в ядерных реакторах и в атомной бомбе.
Уран образует довольно большое число соединений. Наиболее характерными из них являются соединения урана (VI).
Триоксид урана, или урановый ангидрид, UO3 (оранжевый порошок) имеет характер амфотерного оксида. При растворении его в кислотах образуются соли (например, UO2Cl2), в которых катионом является UO22+, называемый уранилом.
Соли уранила обычно окрашены в желтовато-зеленый цвет и хорошо растворимы в воде. При действии щелочей и а растворы солей уранила получаются соли урановой кислоты H2UO4 — уранаты и двуурановой кислоты H2U2O7 диуранаты, например, уранат натрия Na2UO4 и диуранат натрия Na2U2O7. Диураиат натрия применяется для получения уранового стекла, флуоресцирующего желтовато-зеленым светом.
| <<< Назад 221. Лантаноиды. |
Вперед >>> Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП |
