Книга: Общая химия
215. Кадмий (Cadmium).
| <<< Назад 214. Цинк (Zincum). |
Вперед >>> 216. Ртуть (Hydrargyrum). |
215. Кадмий (Cadmium).
По своим свойствам кадмий сходен с цинком и обычно содержится как примесь в цинковых рудах. По распространенности в природе он значительно уступает цинку; содержание кадмия в земной коре составляет всего около 10-5% (масс.).
Получают кадмий из отходов цинкового производства путем обработки последних серной кислотой с последующим выделением металлического кадмия цинком:
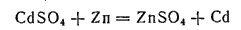
Для очистки полученный продукт растворяют в разбавленной серной кислоте и подвергают электролизу.
Кадмий представляет собой серебристо-белый, мягкий, ковкий, тягучий металл. В ряду напряжений он стоит дальше цинка, но спереди водорода и вытесняет последний из кислот.
- 605 -
Поскольку Cd(OH)2 - слабый электролит, то соли кадмия гидролизуются и их растворы имеют кислую реакцию.
Кадмий сильно поглощает медленные нейтроны. Поэтому кадмиевые стержни применяют в ядерных реакторах для регулирования скорости цепной реакции. Кадмий используется в щелочных аккумуляторах (см. § 244), входит как компонент в некоторые сплавы. Например, сплавы меди, содержащие около 1% Cd (кадмиевая бронза), служат для изготовления телеграфных, телефонных, троллейбусных проводов, так как эти сплавы обладают большей прочностью и износостойкостью, чем медь. Ряд легкоплавких сплавов, например, применяющиеся в автоматических огнетушителях, содержат кадмий. Несмотря на сравнительно высокую стоимость, кадмий применяется для кадмирования стальных изделий, так как он несет на своей поверхности оксидную пленку, обладающую защитным действием. В морской воде и в некоторых других условиях кадмирование более эффективно, чем цинкование.
При сильном накаливании кадмий сгорает, превращаясь в бурый оксид кадмия CdO.
Гидроксид кадмия Cd(OH)2 в отличие от гидроксида цинка не обладает заметно выраженными кислотными свойствами и практически не растворяется в щелочах.
Из солей кадмия отметим сульфид кадмия CdS, выпадающий в виде желтого осадка из растворов солей кадмия при действии сероводорода. Сульфид кадмия применяется для изготовления желтой краски и цветных стекол.
Все растворимые в воде и в разбавленных кислотах соединения кадмия ядовиты. Весьма опасно также вдыхание воздуха, содержащего «дым» оксида кадмия.
| <<< Назад 214. Цинк (Zincum). |
Вперед >>> 216. Ртуть (Hydrargyrum). |
