Книга: Общая химия
213. Стронций (Strontium). Барий (Barium).
| <<< Назад 212. Жесткость природных вод и ее устранение. |
Вперед >>> 214. Цинк (Zincum). |
213. Стронций (Strontium). Барий (Barium).
Стронций и барий встречаются в природе главным образом в виде сульфатов и карбонатов, образуя минералы целестин SrSO4, стронцианит SrCO3, барит BaSO4 и витерит BaCI3. Содержание стронция и бария в земной коре соответственно равно 0,04 и 0,05% (масс.), т. е. значительно меньше, чем содержание кальция.
Металлические стронций и барий очень активны, быстро окисляются на воздухе, довольно энергично взаимодействуют с водой (особенно барий) и непосредственно соединяются со многими элементами.
Оксиды стронция и бария SrO и BaO сходны с оксидом кальция. Оба металла образуют также пероксиды. Пероксид бария BaO2 получается при нагревании оксида бария на воздухе примерно до 500°C. При высокой температуре она снова разлагается на оксид и кислород. Пероксид бария, как и пероксид натрия, используют для беления различных материалов.
Гидроксиды стронция и бария Sr(OH)2 и Ba(OH)2 представляют собой сильные основания, лучше растворимые в воде, чем гидроксид кальция: один литр воды при 20°C растворяет 8 г гидроксида стронция и 38 г гидроксида бария. Насыщенный раствор гидроксида бария называется баритовой водой и часто применяется в качестве реактива.
Соли стронция и бария имеют сходство с солями кальция. Карбонаты и сульфаты SrCO3, BaCO3, SrSO4 и BaSO4 обладают очень малой растворимостью в воде и выпадают из раствора в виде осадков, если ионы стронция и бария встречаются с ионами CO32- или SO42-. Этим пользуются при анализе для отделения стронция и бария от других металлов.
Характерным отличием всех трех металлов друг от друга может служить окраска, сообщаемая их летучими солями несветящему пламени. Соли кальция окрашивают пламя в кирпично-красный цвет, соли стронция — в карминовокрасный, а соли бария — в желтовато-зеленый.
ПОБОЧНАЯ ПОДГРУППА ВТОРОЙ ГРУППЫ
Элементы этой подгруппы — цинк, кадмий и ртуть — характеризуются наличием двух электронов в наружном слое атома и восемнадцати в предыдущем. Строение двух наружных электронных оболочек их атомов можно отразить формулой (n-1)s2(n-1)p6(n-1)d10ns2.
В табл. 34 приведены некоторые свойства этих металлов.
Восстановительные свойства элементов подгруппы цинка выражены значительно слабее, чем у элементов главной подгруппы. Это объясняется меньшими размерами атомов и, соответственно, более высокими энергиями ионизации этих элементов по сравнению с соответствующими элементами главной подгруппы (ср. данные табл. 33 и 34).
- 600 -
Таблица 34. Некоторые свойства элементов побочной подгруппы второй группы
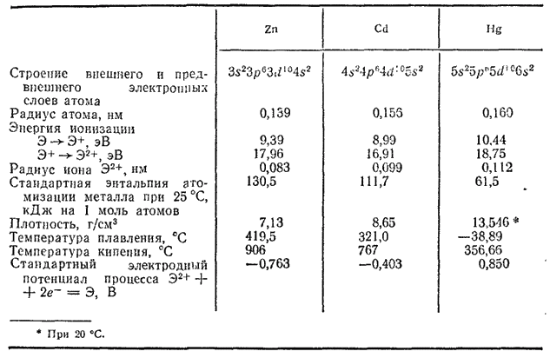
У атомов цинка, кадмия и ртути, как и у атомов элементов подгруппы меди, d-подуровень второго снаружи электронного слоя целиком заполнен. Однако у элементов подгруппы цинка этот подуровень уже вполне стабилен и удаление из него электронов требует очень большой затраты энергии. Поэтому рассматриваемые элементы проявляют в своих соединениях степень окисленности +2. Ртуть, кроме того, образует соединения, в которых ее степень окисленности равна +1; но, как будет показано ниже (см. § 216), и в этих соединениях ртуть следует считать двухвалентной.
Характерной особенностью элементов подгруппы цинка, сближающей их с элементами подгруппы меди, является их склонность к комплексообразованию.
| <<< Назад 212. Жесткость природных вод и ее устранение. |
Вперед >>> 214. Цинк (Zincum). |
