Книга: Общая химия
209. Бериллий (Beryllium).
| <<< Назад Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ |
Вперед >>> 210. Магний (Magnesium). |
209. Бериллий (Beryllium).
Бериллий мало распространен в земной коре [0,0004% (масс)]. Он входит в состав некоторых минералов, из которых чаще всего встречается берилл Be3Al2(SiO3)6. Некоторые разновидности берилла, окрашенные примесями в различные цвета, относятся к драгоценным камням. Таковы, например, зеленые изумруды, голубовато-зеленые аквамарины.
Металлический бериллий получают электролизом расплавов его соединений, главным образом хлорида бериллия. Электролитом служит расплав, содержащий 50% (масс.) BeCl2 и 50% (масс.) NaCl использование расплава такого состава позволяет понизить температуру, при которой проводят электролиз, до 300°C (чистый хлорид бериллия плавится при 440°C).
Бериллий очень твердый, хрупкий, белый, легкий металл. Он коррозионно стоек вследствие образования на его поверхности оксидной пленки, обладающей защитными свойствами. Вода почти не действует на бериллий; в кислотах же он легко растворяется с выделением водорода.
Для бериллия характерно, что в водных растворах щелочей он тоже растворяется; при этом образуются гидроксобериллаты:
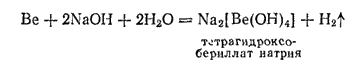
Металлический бериллий обладает многими замечательными свойствами. Тонкие пластинки бериллия хорошо пропускают рентгеновские лучи и служат незаменимым материалом для изготовления окошек рентгеновских трубок, через которые лучи выходят наружу. Главной областью применения бериллия являются сплавы, в которые этот металл вводится как легирующая добавка. Кроме бериллиевых бронз (см. § 200), применяются сплавы никеля с 2-4% Be , которые по коррозионной стойкости, прочности и упругости сравнимы с высококачественными нержавеющими сталями, а в некоторых отношениях превосходят их. Они применяются для изготовления пружин и хирургических инструментов. Небольшие добавки бериллия к магниевым сплавам повышают их коррозионную стойкость. Такие сплавы, а также сплавы алюминия с бериллием применяются в авиастроении. Бериллий — один из лучших замедлителей и отражателей нейтронов в высокотемпературных ядерных реакторах.
- 590 -
В связи с ценными свойствами бериллия производство его быстро растет.
Как уже указывалось, второй снаружи электронный слой атома бериллия построен иначе, чем у остальных элементов подгруппы: он содержит не восемь, а только два электрона. Поэтому, в сравнении с другими элементами подгруппы (см. табл. 32), радиус атома, а в особенности иона, бериллия непропорционально мал, энергия его ионизации велика, а кристаллическая решетка очень прочна (высокая температура плавления и большая энтальпия атомизации).
Отличие строения атома бериллия от строения атома магния и щелочноземельных элементов сказывается и на свойствах его соединений. Так, Be(OH)2 — единственное в подгруппе основание, обладающее амфотерными свойствами (см. ниже). Кроме того, для щелочноземельных металлов и магния характерно образование ионных соединений, тогда как атомы бериллия обычно связаны с атомами других элементов скорее ковалентной связью, чем ионной.
По своим химическим свойствам бериллий в значительной степени сходен с алюминием, находящимся в третьем периоде и в третьей группе периодической системы, т. е. правее и ниже бериллия. Это явление, носящее название диагонального сходства, наблюдается не только у бериллия, но и у некоторых других элементов. Например, бор по многим химическим свойствам сходен с кремнием.
При образовании соединений типа BeX2, например Bel2, атомы бериллия переходят в возбужденное состояние:
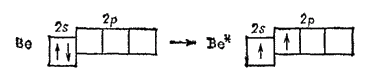
При этом за счет распаривания электронов образуются две ковалентные связи и происходит sp-гибридизация: валентные электроны образуют два равноценных sp-гибридных облака, вытянутых в противоположных направлениях. Таким образом, молекулы BeX2 имеют линейное строение. Более подробно sp-гибридизация орбиталей в атоме бериллия рассмотрена в § 43; см. также рис. 39 на стр. 130.
Общее число валентных электронов в молекулах, подобных BeCl2, недостаточно для того, чтобы целиком заполнить внешний электронный слой атома бериллия. Поэтому такие молекулы называют электронодефицитными. Так, в молекуле BeCl2
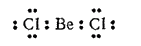
в наружном слое атома бериллия находятся всего четыре электрона.
- 591 -
Поэтому атом бериллия способен быть акцептором электронных пар и образовывать еще две ковалентные связи по донорно-акцепторному способу. В то же время каждый атом хлора, входящий в состав молекулы BeCl2, обладает неподеленными электронными парами и может выступать в качестве их донора. Поэтому при охлаждении газообразного хлорида бериллия между отдельными молекулами BeCl2 возникают новые ковалентные связи в соответствии со схемой:
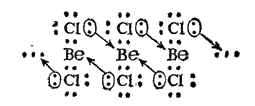
В итоге, при конденсации хлорида бериллия образуются линейные полимерные цепи, в которых атомы хлора играют роль мостиков, связывающих атомы бериллия. Атомы, выполняющие такую функцию, называются мостиковыми атомами. Схема строения линейного полимера BeCl2 изображена на рис. 163. Видно, что ковалентность и координационное число бериллия в твердом BeCl2 равны четырем.
Это значение ковалентности и координационного числа характерно для многих устойчивых соединений бериллия. Так, при взаимодействии BeF2 с фторидами щелочных металлов образуются комплексные фторобериллаты, содержащие ион BeF42-, например:
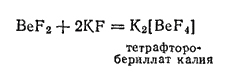
Здесь атом бериллия находится в состоянии sp3-гибридизации, благодаря чему ион BeF42- построен в форме тетраэдра. Тетраэдрическое расположение атомов бериллия и кислорода характерно и для кристаллического оксида бериллия. В водных растворах ион бериллия, по-видимому, находится также в виде тетраэдрических аквакомплексов [Be(H2O)4]2+.
Оксид бериллия BeO — белое, очень тугоплавкое вещество. Применяется в качестве химически устойчивого огнеупорного материала (в реактивных двигателях, для изготовления тиглей, в электротехнике) и как конструкционный материал в ядерных реакторах.
Гидроксид бериллия Be(OH)2 имеет ясно выраженный амфотерный характер, чем резко отличается от гидроксидов щелочноземельных металлов.
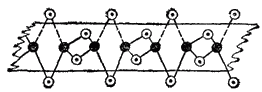
Рис. 163. Схема строения линейного полимера (BeCl2)n : черные кружки - атомы алюминия, светлые — атомы хлора.
- 592 -
В воде он практически нерастворим, но легко растворяется как в кислотах, так и в щелочах, в последнем случае с образованием гидроксоберпллатов:
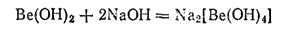
Кислотные свойства гидроксида бериллия выражены очень слабо, поэтому в водном растворе бериллаты сильно гидролизуются.
Большинство солей бериллия, в том числе и сульфат, хорошо растворимы в воде, тогда как сульфаты щелочноземельных металлов в воде практически нерастворимы. В водных растворах ионы Be2+ подвергаются гидролизу, благодаря чему растворы солей бериллия имеют кислую реакцию.
Все соединения бериллия токсичны. В частности, весьма опасно пребывание в атмосфере, содержащей пыль бериллия или его соединений.
| <<< Назад Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ |
Вперед >>> 210. Магний (Magnesium). |
