Книга: Общая химия
206. Природа химической связи в комплексных соединениях.
| <<< Назад 205. Пространственное строение и изомерия комплексных соединений. |
Вперед >>> 207. Диссоциация комплексных соединений в растворах. |
206. Природа химической связи в комплексных соединениях.
Образование многих комплексных соединений можно в первом приближении объяснить электростатическим притяжением между центральным катионом и анионами или полярными молекулами лигандов. Наряду с силами притяжения действуют и силы электростатического отталкивания между одноименно заряженными (или, в случае полярных молекул, одинаково ориентированными) лигандами. В результате образуется устойчивая группировка атомов (ионов), обладающая минимальной потенциальной энергией.
Количественные расчеты на основе такой электростатической модели впервые были выполнены В. Косселем и А. Магнусом, которые принимали ионы за недеформируемые шары и учитывали их взаимодействие по закону Кулона. Результаты этих расчетов удовлетворительно передают зависимость координационного числа от заряда центрального иона. Однако простая электростатическая теория не в состоянии объяснить избирательность (специфичность) комплексообразования, поскольку она не принимает во внимание природу центрального атома и лигандов, особенности строения их электронных оболочек. Для учета этих факторов электростатическая теория была дополнена поляризационными представлениями (см. § 46), согласно которым комплексообразованию благоприятствует участие в качестве центральных атомов небольших многозарядных катионов d-элементов, обладающих сильным поляризующим действием, а в качестве лигандов — больших, легко поляризующихся ионов или молекул. В этом случае происходит деформация электронных оболочек центрального атома и лигандов, приводящая к их взаимопроникновению, что и вызывает упрочнение связей.
Поляризационные представления оказались полезными для объяснения устойчивости, кислотно-основных и окислительно-восстановительных свойств комплексных соединений, но многие другие их свойства остались необъясненными. Так, с позиций электростатической теории все комплексы с координационным числом 4 должны иметь тетраэдрическое строение, поскольку именно такой конфигурации соответствует наименьшее взаимное отталкивание лигандов. В действительности, как мы уже знаем, некоторые подобные комплексы, например, образованные платиной (II), построены в форме плоского квадрата. Электростатическая теория не в состоянии объяснить особенности реакционной способности комплексных соединений, их магнитные свойства и окраску. Более точное и полное описание свойств и строения комплексных соединений может быть получено только на основе квантовомеханических представлений о строении атомов и молекул.
В настоящее время существует несколько подходов к квантовомеханическому описанию строения комплексных соединений.
- 576 -
Теория кристаллического поля основана на представлении об электростатической природе взаимодействия между центральным ионом и лигандами. Однако, в отличие от простой ионной теории, здесь учитывается различное пространственное расположение d-орбиталей (см. рис. 20 на стр. 81) и связанное с этим различное изменение энергии d-электронов центрального атома, вызываемое их отталкиванием от электронных облаков лигандов.
Рассмотрим состояние ?-орбиталей центрального иона. В свободном ионе электроны, находящиеся на каждой из пяти ?-орбиталей, обладают одинаковой энергией (рис. 160, а). Представим себе, что лиганды создают равномерное сферическое электростатическое поле, в центре которого находится центральный ион. В этом гипотетическом случае энергия d-орбиталей за счет отталкивающего действия лигандов возрастает на одинаковую величину, т. е. все d-орбитали останутся энергетически равноценными (рис. 160,6). В действительности, однако, лиганды неодинаково действуют на различные d-орбитали: если орбиталь расположена близко к лиганду, энергия занимающего ее электрона возрастает более значительно, чем в том случае, когда орбиталь удалена от лиганда. Например, при октаэдрическом расположении лигандов вокруг центрального иона наибольшее отталкивание испытывают электроны, находящиеся на орбиталях dz2 и dx2-y2 направленных к лигандам (рис. 161, а и б); поэтому их энергия будет более высокой, чем в гипотетическом сферическом поле. Напротив, dxy, dxz и dyz -орбитали направлены между лигандами (рис. 161, в), так что энергия находящихся здесь электронов будет ниже, чем в сферическом поле. Таким образом, в октаэдрическом поле лигандов происходит расщепление d-уровня центрального иона на два энергетических уровня (рис. 160, в): более высокий уровень, соответствующий орбиталям dz2 и dx2-y2 (их принято обозначать d? или ?g ), и более низкий уровень, отвечающий орбиталям dxy, dxz и dyz (эти орбитали обозначают d? или t2g ).
Разница в энергиях уровней d? и d?, называемая энергией расщепления, обозначается буквой ?; ее можно экспериментально определить по спектрам поглощения комплексных соединений.
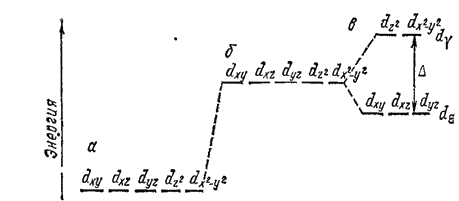
Рис. 160. Схема энергетических уровней d-орбиталей центрального иона: а — свободный ион; б — ион в гипотетическом сферическом поле; в — ион в октаэдрическом поле лигандов.
- 577 -
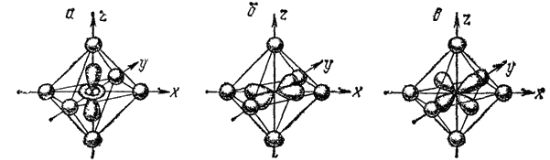
Рис. 161. Орбитали dz2(а) и dx2-y2(б) и dxy(в) в октаэдрическом поле лигандоз (лиганды условно изображены в виде шариков).
Значение ? зависит как от природы центрального атома, так и от природы лигандов: лиганды, создающие сильное поле, вызывают большее расщепление энергетических уровней, т. е. более высокое значение ?.
По величине энергии расщепления лиганды располагаются в следующем порядке (так называемый спектрохимический ряд):
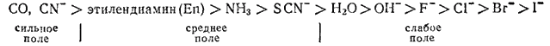
В начале этого ряда находятся лиганды, создающие наиболее сильное поле, в конце — создающие слабое поле.
Электроны центрального иона распределяются по d-орбиталям так, чтобы образовалась система с минимальной энергией. Это может быть достигнуто двумя способами: размещением электронов на d?-орбиталях, отвечающих более низкой энергии, или равномерным распределением их по всем d-орбиталям, в соответствии с правилом Хунда (см. § 32). Если общее число электронов, находящихся на d-орбиталях центрального иона, не превышает трех, то они размещаются на орбиталях более низкого энергетического уровня d? по правилу Хунда. Так, у иона Cr3+, имеющего электронную конфигурацию внешнего слоя 3d3, каждый из трех d-электронов занимает одну из трех d?-орбиталей.
Иное положение складывается, когда на d-орбиталях центрального иона находится большее число электронов. Размещение их в соответствии с правилом Хунда требует затраты энергии для перевода некоторых электронов на d?-орбитали. С другой стороны, при размещении максимального числа электронов на d?-орбиталях нарушается правило Хунда и, следовательно, необходима затрата энергии для перевода некоторых электронов на орбитали, на которых уже имеется по одному электрону.
- 578 -
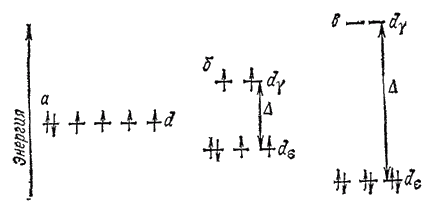
Рис. 162. распределение электронов иона Co3+ по d-орбиталям: а — в гипотетическом сферическом поле; б — в слабом октаэдрическом поле лигандов (комплекс [CoF6]3-); в - в сильном октаэдрическом поле лигандов (комплекс [Co(CN)6]3-).
- 578 -
Поэтому в случае слабого поля, т. е. небольшой величины энергии расщепления, энергетически более выгодным оказывается равномерное распределение d-электронов по всем d-орбиталям (в соответствии с правилом Хунда); при этом центральный ион сохраняет высокое значение спина, так что образуется высокоспиновый парамагнитный комплекс. В случае же сильного поля (высокое значение энергии расщепления) энергетически более выгодным будет размещение максимального числа электронов на d?-орбиталях; при этом создается низкоспиновый диамагнитный комплекс.
С этой точки зрения понятно, почему, например, комплекс [CoF6]3- парамагнитен, а комплекс [Co(CN)6]3- диамагнитен. Положение лигандов F- и CN- в спектрохимическом ряду (см. выше) показывает, что ионам CN- соответствует значительно более высокая энергия расщепления ?, чем ионам F-. Поэтому в рассматриваемых комплексах электроны центрального иона Co3+ распределяются по d-орбиталям так, как это показано на рис. 162: комплекс [CoF6]3- — высокоспиновый, а комплекс [Co(CN)6]3- низкоспиновый.
Мы рассмотрели теорию кристаллического поля в приложении к комплексам с октаэдрическим расположением (октаэдрической координацией) лигандов. С аналогичных позиций могут быть рассмотрены и свойства комплексов с иной, например тетраэдрической, координацией.
На основе теории кристаллического поля удается объяснить не только магнитные свойства комплексных соединений, но и их специфическую окраску. Так, в комплексе [Ti(H2O)6]3+ имеет один Ti3+-электрон (электронная конфигурация d1). В нормальном (невозбужденном) состоянии этот электрон находится на одной из d?-орбиталей, но при затрате некоторой энергии ( ? = 238 кДж/моль ) может возбуждаться и переходить на d?-орбиталь. Длина волны света, поглощаемого при этом переходе и соответствующего указанной энергии, равна 500 нм: это и обусловливает фиолетовую окраску комплекса [Ti(H2O)6]3+. При таком рассмотрении становится понятным, почему комплексы, образованные ионами Cu+, Ag+, Zn2+ и Cd2+, как правило, бесцветны; эти ионы имеют электронную конфигурацию d10, так что все d-орбитали заполнены и переход электронов с d? на d?-орбитали невозможен. Ион же Cu2+ образует окрашенные комплексы: он обладает электронной конфигурацией d9, так что один из d?-электронов может при возбуждении переходить на d?-орбиталь.
- 579 -
Хотя теория кристаллического поля оказалась плодотворной с трактовке магнитных, оптических и некоторых других свойств комплексных соединений, она не смогла объяснить положения лигандов в спектрохимическом ряду, а также сам факт образования некоторых комплексов, например, так называемых «сэндвичевых» соединений — дибензолхрома Cr(C6H6)2, ферроцена CFe(C5H5)2 и их аналогов. Дело в том, что теория кристаллического поля, учитывая влияние лигандов на центральный ион, не принимает во внимание участия электронов лигандов в образовании химических связей с центральным ионом. Поэтому применение теории кристаллического поля ограничено, главным образом, комплексными соединениями с преимущественно ионным характером связи между центральным атомом и лигандами.
Метод валентных связей в приложении к комплексным соединениям базируется на тех же представлениях, что и в простых соединениях (см. §§ 39—44). При этом принимается во внимание, что химические связи, возникающие при комплексооб-разовании имеют донорно-акцепторное происхождение, т. е. образуются за счет неподеленной электронной пары одного из взаимодействующих атомов и свободной орбитали другого атома. Рассмотрим с этих позиций строение некоторых комплексных соединений.
В молекуле аммиака атом азота находится в состоянии sp3-гибридизации, причем на одной из его гибридных орбиталей находится неподеленная электронная пара. Поэтому при донорно-акцепторном взаимодействии молекулы NH3 с ионом H+ образуется NH4+ имеющий тетраэдрическую конфигурацию. Аналогично построен комплексный [BF]4-: здесь донором электронной пары служит анион F-, а акцептором — атом бора в молекуле BF3, обладающий незанятой орбиталью внешнего электронного слоя и переходящий при комплексообразовании в состояние sp3-гибридизации.
Такую же геометрическую конфигурацию (тетраэдр) имеют некоторые комплексы элементов подгруппы цинка, например [Zn(NH3)4]sp2+, [Cd(NH3)4]2+, [HgI4]2-. Так, в комплексе [Zn(NH3)4]sp2+ цинка предоставляет для электронных пар лигандов (условно показанных на схеме точками) одну 4s- и три 4p-орбитали
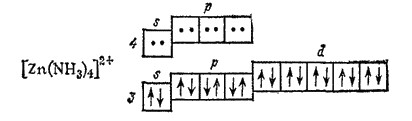
причем осуществляется sp3-гибридизация, соответствующая размещению лигандов в вершинах тетраэдра (тетраэдрическая координация).
- 580 -
Ионы d-элементов с четырьмя занятыми d-орбиталями (Pt2+, Pd2+, Au3+) при координационном числе 4 предоставляют для электронных пар лигандов одну (n-1)d-, одну ns- и две np-орбитали, например, в комплексе [Pt(NH3)4]2+:
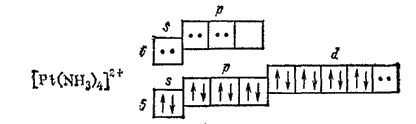
этом осуществляется гибридизация dsp3, отвечающая размещению лигандов в вершинах квадрата (квадратная координация). Поэтому такие комплексы, как [Pt(NH3)4]2+, [PtCl4]2-, обладают структурой плоского квадрата.
Координационному числу 6 соответствует гибридизация d2sp3 и октаэдрическое расположение лигандов. Такая координация имеет место, например, в комплексах платины (IV):
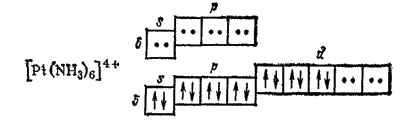
Такая же октаэдрическая координация осуществляется в комплексах [Co(NH3)6]3+, [Fe(CH)6]4-, [RhCl6]3- и др.
Координационному числу 2 отвечает гибридизация sp-типа и линейная координация лигандов, например, в комплексе [Ag(NH3)2]+:
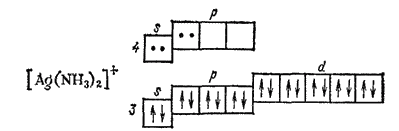
Рассмотренные примеры показывают, что метод ВС успешно объясняет определенные значения координационных чисел и геометрические формы комплексных частиц. Правильно описываются с позиций этого метода и различия в магнитных свойствах (диамагнитность или парамагнитность) комплексных соединений. Однако некоторые их свойства (например, спектры поглощения) не находят с позиций метода ВС удовлетворительного объяснения. Кроме того, взаимодействие между центральным атомом и лигандами в комплексных соединениях не сводится только к передаче электронов от лиганда.
- 581 -
Существуют лиганды, которые способны принимать электроны металла на вакантные орбитали, например на свободные d-орбитали (в молекуле PF3 или в ионе SnCl3-), или на незаполненные разрыхляющие орбитали (в молекулах C2H4, CO,NO).
Такие лиганды называют ?-акцепторами, а связь их с центральным атомом ?-дативной. Строение многих из открытых в последнее время комплексных соединений, например «сэндвичевых», нельзя объяснить с точки зрения метода ВС.
Метод молекулярных орбиталей. Молекулярные орбитали в комплексных соединениях образуются по тому же принципу и обладают теми же свойствами, что и молекулярные орбитали в двухатомных молекулах (см. § 45). Отличие заключается в том, что в комплексных соединениях МО являются многоцентровыми, делокализованными, подобно тому, что имеет место, например, в молекуле бензола (см. § 167).
Метод МО стал в настоящее время ведущим, наиболее плодотворным в теории строения комплексных соединений. В частности, он успешно объясняет строение и свойства уже упоминавшихся «сэндвичевых» соединений, например Cr(C6H6)2, Fe(C5H5)2, в которых центральный атом находится между циклическими органическими молекулами и связан с ними делокализованными многоцентровыми связями. Приложение метода МО к объяснению строения комплексных соединений рассматривается в специальных руководствах.
| <<< Назад 205. Пространственное строение и изомерия комплексных соединений. |
Вперед >>> 207. Диссоциация комплексных соединений в растворах. |
- 203. Основные положения координационной теории.
- 204. Основные типы и номенклатура комплексных соединений.
- 205. Пространственное строение и изомерия комплексных соединений.
- 206. Природа химической связи в комплексных соединениях.
- 207. Диссоциация комплексных соединений в растворах.
- 208. Влияние координации на свойства лигандов и центрального атома.
- 205. Пространственное строение и изомерия комплексных соединений.
- Коротко о соединениях серы
- 207. Диссоциация комплексных соединений в растворах.
- … и в других соединениях
- Факторы, влияющие на скорость химической реакции.
- Основы химической структуры жизни
- 57. Скорость химической реакции.
- 204. Основные типы и номенклатура комплексных соединений.
- Коротко о соединениях цинка
