Книга: Общая химия
202. Золото (Aurum).
| <<< Назад 201. Серебро (Argentum). |
Вперед >>> Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ |
202. Золото (Aurum).
Золото встречается в природе почти исключительно в самородном состоянии, главным образом в виде мелких зерен, вкрапленных в кварц или содержащихся в кварцевом песке. В небольших количествах золото встречается в сульфидных рудах железа, свинца и меди. Следы его открыты в морской воде.
- 562 -
Общее содержание золота в земной коре составляет всего 5·10-7% (масс.).
В СССР месторождения золота находятся в Сибири и на Урале. Крупные месторождения золота имеются в Южной Африке, на Аляске, в Канаде и Австралии.
Золото отделяется от песка и измельченной кварцевой породы промыванием водой, которая уносит частицы песка, как более легкие, или обработкой песка жидкостями, растворяющими золото. Чаще всего применяется раствор цианида натрия NaCN, в котором золото растворяется в присутствии кислорода с образованием комплексных анионов [Au(CN)2]-:
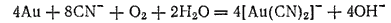
Из полученного раствора золото выделяют цинком:
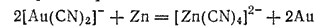
Осажденное золото обрабатывают для отделения от него цинка разбавленной серной кислотой, промывают и высушивают. Дальнейшая очистка золота от примесей (главным образом от серебра) производится обработкой его горячей концентрированной серной кислотой или путем электролиза.
Метод извлечения золота из руд с помощью растворов цианидов калия или натрия был разработан в 1843 г. русским инженером П. Р. Багратионом. Этот метод, принадлежащий к гидрометаллургическим способам получения металлов, в настоящее время наиболее распространен в металлургии золота.
Золото — ярко-желтый блестящий металл. Оно очень ковко и пластично; путем прокатки из него можно получить листочки толщиной менее 0,0002 мм, а из 1 г. золота можно вытянуть проволоку длиной 3,5 км. Золото — прекрасный проводник теплоты и электрического тока, уступающий в этом отношении только серебру и меди.
Ввиду мягкости золото употребляется в сплавах, обычно с серебром или медью. Эти сплавы применяются для электрических контактов, для зубопротезирования, в ювелирном деле.
В химическом отношении золото — малоактивный металл. На воздухе оно не изменяется, даже при сильном нагревании. Кислоты в отдельности не действуют на золото, но в смеси соляной и азотной кислот (царской водке) золото легко растворяется. Так же легко растворяется золото в хлорной воде и в аэрируемых (продуваемых воздухом) растворах цианидов щелочных металлов. Ртуть тоже растворяет золото, образуя амальгаму, которая при содержании более 15% золота становится твердой.
Известны два ряда соединений золота, отвечающие степеням окисленности +1 и +3.
Так, золото образует два оксида — оксид золота(I), или закись золота, Au2O и оксид золота (III), или окись золота, Au2O3.
- 563 -
Более устойчивы соединения, в которых золото имеет степень окисленности +3.
При растворении золота в царской водке получается комплексная тетралхлорозолотая, или золотохлористоводородная, кислота H[AuCl4], которая кристаллизуется в виде светло-желтых игл состава H[AuCl4]·4H2O (обычный продажный препарат золота). Известны хорошо кристаллизующиеся соли этой кислоты, например Na[AuCl4], в растворах которых золото находится в виде комплексного аниона [AuCl4]-.
Если осторожно нагревать тетрахлорозолотую кислоту, то она разлагается с выделением HCl и красновато-коричневых кристаллов хлорида AuCl3.
Щелочи осаждают из растворов тетрахлорозолотой кислоты бурый гидроксид золота (III) Au(OH)3, называемый также золотой кислотой, так как это вещество обладает слабокислотными свойствами и образует соли. При 100°C золотая кислота теряет воду, превращаясь в бурый оксид золота (III) Au2O3.
При нагревании хлорида золота (III) в струе диоксида углерода до 180°C получается хлорид золота (I) AuCl в виде белого малорастворимого в воде вещества. Из растворов хлорида золота (I) щелочи осаждают фиолетовый оксид золота (I) Au2O.
Все соединения золота легко разлагаются при нагревании с выделением металлического золота,
| <<< Назад 201. Серебро (Argentum). |
Вперед >>> Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ |
