Книга: Большое космическое путешествие
Глава 6 Звездные спектры
| <<< Назад Глава 5 Как звезды излучают энергию (II) |
Вперед >>> Глава 7 Жизнь и смерть звезд (I) |
Глава 6
Звездные спектры
Автор: Нил Деграсс Тайсон
Что на самом деле происходит внутри звезды? Звезда – это не просто маячок, который достаточно включить, чтобы с его поверхности полился свет. Глубоко в недрах звезды протекают термоядерные процессы, в результате которых выделяется энергия, и эта энергия постепенно пробивается к поверхности звезды, где высвобождается и со скоростью света летит на Землю, а также во всю Вселенную. Давайте проанализируем, что происходит при продвижении такой тучи фотонов сквозь материю – ведь без сопротивления при этом не обходится.
Для начала нужно понять, через что пробиваются фотоны на пути к поверхности Солнца. Наша звезда и большинство остальных состоят преимущественно из водорода – самого распространенного элемента во Вселенной. 90 % всех атомных ядер – это ядра водорода, 8 % – ядра гелия, а оставшиеся 2 % приходятся на все остальные элементы Периодической системы. История всего водорода и большей части гелия прослеживается вплоть до Большого взрыва, тогда же появилось ничтожное количество лития. Остальные элементы уже позже синтезировались в звездах. Если вы – поклонник той точки зрения, что земная жизнь есть нечто уникальное, то должны считаться со следующим важным фактом: если расставить по частоте встречаемости пять важнейших элементов во Вселенной – водород, гелий, кислород, углерод и азот, то этот набор будет очень напоминать химический состав человеческого организма. Какова основная молекула в теле человека? Это вода – вы на 80 % состоите из H2O. Если расщепить воду, то выделится водород, элемент номер один в человеческом организме. В вас совершенно нет гелия – за исключением того, что вы вдыхаете из наполненного гелием шарика, чтобы изменить голос на писклявый. Но гелий химически инертен. Он расположен в крайнем правом столбце Периодической таблицы; это значит, что его внешняя электронная оболочка целиком заполнена, там нет свободных «парковочных мест», куда можно было бы вставить электроны от других атомов, поэтому гелий ни с чем не реагирует. Даже если бы у вас был гелий, вам было бы не на что его применить.
Далее в человеческом организме идет кислород – опять же, его много, так как он присутствует в молекуле воды H2O. После кислорода идет углерод – основа всей органической химии. Далее идет азот. Если не считать гелия, который ни с чем не реагирует, то в земном человеческом организме наиболее распространены те же элементы, что и в космосе. Если бы мы состояли из какого-то редкого элемента, например из изотопа висмута, то могли бы утверждать, что на этой планете произошло что-то уникальное. Но учитывая, что мы состоим как раз из тех элементов, что наиболее распространены в космосе, приходится смиренно признать, что с химической точки зрения мы ничем не примечательны. С другой стороны, есть нечто поучительное и даже вдохновляющее в осознании, что все мы действительно сотворены из звездного вещества. Как будет рассказано в нескольких следующих главах, кислород, углерод и азот синтезируются в звездах спустя миллиарды лет после Большого взрыва. Мы родились во Вселенной, живем в этой Вселенной, и Вселенная живет внутри нас.
Рассмотрим газовое облако – космическую смесь водорода, гелия и остальных элементов – и обратим внимание на то, что там происходит. В центре атома находится ядро, состоящее из протонов и нейтронов, вокруг ядра вращаются по орбитам электроны. Удобно, пусть и графически неверно, представлять себе простую классическую квантовую модель атома, которую Нильс Бор предложил около 100 лет назад. У такого атома есть основное состояние – такая орбита, на которой электрон обладает наименьшей внутренней энергией; назовем это основное состояние «энергетический уровень 1». На следующей возможной орбите электрон будет уже в возбужденном состоянии, это будет энергетический уровень 2. Давайте изобразим атом с двумя энергетическими уровнями, чтобы не усложнять картину (рис. 6.1). В атоме есть ядро и облако электронов, находящихся «на орбитах» вокруг ядра. Но эти орбиты не похожи на планетные, о которых мы говорили, обсуждая гравитацию, планеты и Ньютона. Вообще, здесь было бы правильнее говорить не об орбитах, а об орбиталях. Они называются орбиталями, поскольку похожи на орбиты, но могут принимать самые разные формы. На самом деле, это «вероятностные облака», в разных частях которых с той или иной вероятностью может находиться электрон. Электронные облака. Некоторые из них сферические, другие – продолговатые. Орбитали объединяются в семейства, для одних семейств характерны более высокие энергии, чем для других. Давайте абстрагируемся от этого и поговорим просто об энергетических уровнях, но на самом деле будем рисовать орбитали, занятые электронами, вращающимися вокруг атомных ядер.
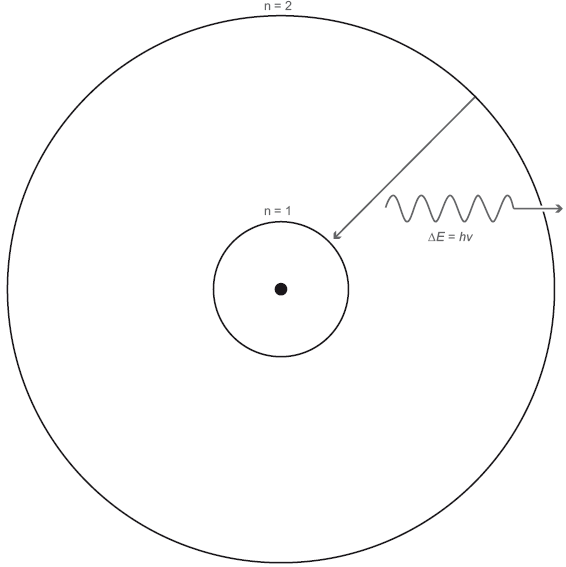
Рис. 6.1. Энергетические уровни в атоме. Показан простой атом с двумя электронными орбиталями, n = 1 и n = 2. Если электрон переходит со второго энергетического уровня на более низкий первый энергетический уровень, он излучает фотон с энергией ?E = h?, где ?E = E2 – E1 – это разница в энергии между первым и вторым энергетическим уровнем. После того как электрон окажется на первом энергетическом уровне, он может поглотить фотон с энергией ?E = h? и вновь подняться на энергетический уровень 2.
Предоставлено Майклом Строссом
Ядро – это точка в центре атома. Энергетический уровень n = 1 соответствует сферической орбитали, расположенной ближе всего к ядру. Энергетический уровень n = 2 – это сферическая орбиталь, расположенная чуть дальше от ядра. Электрон на энергетическом уровне n = 2 уже не так плотно связан с ядром. Электроны и протоны притягиваются; нужна энергия, чтобы отодвинуть электрон от ядра на более отдаленную орбиталь. Энергетический уровень 2 обладает более высокой энергией, чем энергетический уровень 1.
Допустим, есть электрон в основном состоянии, на энергетическом уровне 1. Он не может зависнуть где-нибудь между первым и вторым энергетическими уровнями. Там просто нет места. Это же квантовый мир. Плавных изменений там не бывает. Чтобы электрон мог перескочить на следующий уровень, ему необходимо сообщить энергию. Он должен каким-то образом поглотить энергию, и в данном случае отличным источником энергии был бы фотон. Фотон попадает в электрон, но электрону подойдет не любой фотон, а только такой, энергия которого равна энергетической разнице между двумя уровнями. Заметив такой фотон, электрон проглатывает его и перескакивает на энергетический уровень 2. Если в фотоне чуть больше или чуть меньше энергии, электрон его просто пропустит. Еще отмечу, что атомам, в отличие от людей, не нравится пребывать в возбужденном состоянии. Спустя достаточное время электрон с энергетического уровня 2 спонтанно спустится на более низкий энергетический уровень 1 (как показано прямой стрелкой на рис. 6.1).
Бывает, что достаточное время – это миллионная доля секунды. Электрон недолго пребывает в возбужденном состоянии, будучи в атоме. Итак, что должно произойти, когда электрон опускается на более низкий энергетический уровень? Он должен испустить фотон – новый, но с той же энергией, которую принял с предыдущим фотоном. При переходе на более высокий энергетический уровень фотон поглощается. При переходе на более низкий энергетический уровень фотон излучается, как показано волнистой стрелкой на рис. 6.1. Согласно знаменитому уравнению Эйнштейна, энергия E этого фотона равна h?, где h – постоянная Планка, а ? – частота фотона. Энергия излученного фотона в точности равна разнице между двумя энергетическими уровнями ?E.(Заглавная греческая буква «дельта», ?, часто используется для обозначения разницы или изменения величины). В результате получаем тождество ?E = h?, позволяющее вычислить частоту того фотона, который был излучен электроном, когда тот опустился со второго на первый энергетический уровень.
Вы когда-нибудь играли с фосфоресцирующими фрисби? Чтобы они светились в темноте, их сначала нужно подержать на свету. Например, подвесить перед лампочкой. Что при этом происходит? Электроны в атомах и молекулах игрушки переходят на более высокие энергетические уровни (в таких сравнительно больших атомах много энергетических уровней) и поглощают фотоны света. Создатели игрушки подобрали такой материал, в котором эти электроны каскадируют не сразу, а постепенно, излучая при этом видимый свет. Конечно, такой процесс продолжается не вечно. Свечение прекращается после того, как все электроны вернутся в исходное состояние. Фосфоресцирующие фрисби и светящиеся костюмы скелетов, которые так нравятся детям, светятся благодаря одному и тому же принципу.
Энергия, поглощаемая электроном, может поступить от фотона, но бывают и другие источники энергии. Возможно, пролетающий мимо атом ударит по электрону, и электрон в результате такого воздействия будет заброшен на более высокий энергетический уровень. В данном случае переход осуществляется за счет кинетической энергии. Как подобный механизм работает в облаке газообразного водорода? Во-первых, нужно выяснить, а какова температура этого водородного облака? Температура в кельвинах пропорциональна средней кинетической энергии молекул или атомов в облаке. Переносное движение облака не влияет на эти измерения. Естественно, кинетическая энергия – это энергия движения, поэтому чем выше температура, тем быстрее эти частицы носятся взад-вперед. Если бы я был электроном в основном состоянии и мне дали под зад, то я мог бы проверить энергию этого пинка. Если бы такого пинка хватило, чтобы я пролетел лишь часть пути до второго энергетического уровня, то я остался бы на месте. Но если энергия пинка именно такая, какая нужна для перехода на второй энергетический уровень, то я приму эту энергию, поглощу ее и перейду на второй уровень.
При достаточной температуре можно обеспечить, чтобы вся совокупность атомов и некоторая доля их электронов находились в сравнительно высоком состоянии. Можно поддерживать такое равновесие, так, чтобы любой упавший электрон сразу выталкивался на уровень выше. Примерно так действует жонглер, удерживающий несколько мячиков в воздухе. Все это – функция температуры. При низких температурах абсолютное большинство электронов остается на энергетическом уровне n = 1 и лишь немногие электроны – на энергетическом уровне n = 2. По мере повышения температуры все больше электронов выталкивается на энергетический уровень n = 2.
Резюме. Допустим, межзвездное газовое облако подсвечивается сиянием звезды, температура которой составляет 10 000 К. У большинства атомов – множество очень сложных энергетических уровней, таково устройство природы; энергетические уровни водорода при этом сравнительно просты. Эта разнородная смесь совершенно искажает чистый тепловой спектр, излучаемый звездой с температурой 10 000 К. Посмотрим, какой же хаос получается.
Во-первых, рассмотрим полноценный атом водорода. В нем – бесконечное количество энергетических уровней, соответствующих концентрическим орбиталям, расположенным все дальше и дальше от ядра: n = 1 (основное состояние; ближайшая к ядру орбиталь), n = 2 (первый уровень возбуждения), n = 3, n = 4, n = 5, n = 6 … n = ?. Схема энергетических уровней напоминает лестницу, поэтому называется «лестничная диаграмма». Нижние энергетические уровни, расположенные на которых электроны теснее связаны с ядром, на диаграмме также располагаются внизу (рис. 6.2).
Первое возбужденное состояние водорода – n = 2, на три четверти пути вверх, за ним следует n = 3, затем n = 4, n = 5 и так далее. Электрон с высоким n занимает очень высокую орбиталь и имеет очень слабую связь с протоном. На самом верху диаграммы энергия связи электрона равна нулю. Энергия в атомах измеряется в электрон-вольтах, эВ. Это энергия, требуемая электрону, чтобы преодолеть разность потенциалов в 1 вольт. Допустим, у вас есть фонарик, работающий от девятивольтной батарейки. Каждый электрон, проходя по проводам в фонарике, генерирует 9 эВ энергии в виде света и теплоты. По проводам фонарика может проходить 6,24 ? 1018 электронов в секунду, при этом будет генерироваться энергия в 9 ? (6,24 ? 1018) эВ (или 9 ватт) световой и тепловой энергии в секунду. Следовательно, один электрон-вольт – очень малая энергия; просто такими единицами удобно оперировать, когда речь идет о небольших порциях энергии, обмен которыми происходит при электронных переходах. Например, –13,6 эВ на рисунке соответствует энергетическому уровню n = 1. Эта энергия показана как отрицательная. Чтобы вывести этот электрон из атома, ему нужно сообщить энергию 13,6 эВ. Говорят, что 13,6 эВ – это энергия связывания для основного состояния электрона n = 1. Что будет, если электрон в основном состоянии заметит фотон с энергией более 13,6 эВ? Он сможет поглотить этот фотон? Вот фотон с таким количеством энергии, что электрону с ним делать? Если электрон поглотит такой фотон, то ему хватит энергии, чтобы заскочить выше n = ?. Что выше n = ?? Свобода. Если электрон выскочит туда на уровень энергии выше нуля, то покинет атом и расстанется со своим протоном. В таком случае мы ионизируем атом – оторвем у него электрон.
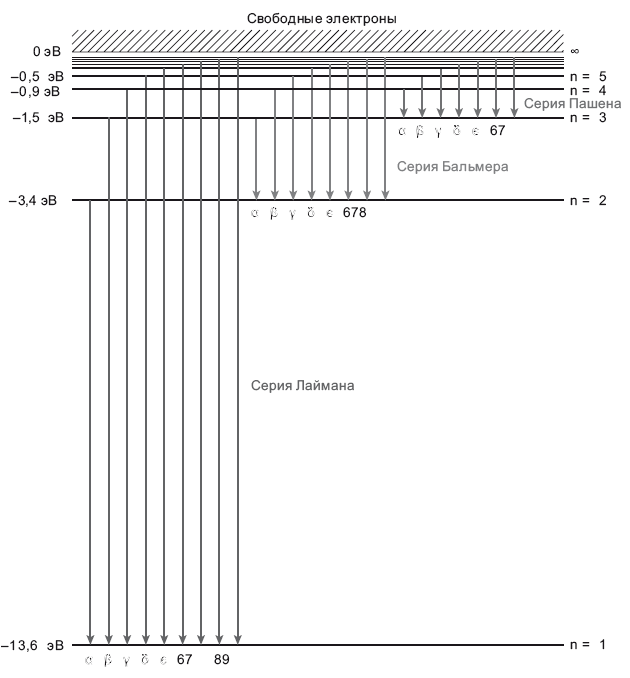
Рис. 6.2. Схема энергетических уровней водорода. Горизонтальными линиями обозначены различные энергетические уровни в атоме водорода в электрон-вольтах (эВ). Стрелками обозначены переходы электрона, при которых он может перескочить с одного энергетического уровня на другой, излучая фотон, энергия которого равна разности потенциалов между этими уровнями. Показаны переходы на первый энергетический уровень (серия Лаймана, где излучаются фотоны в ультрафиолетовой части спектра), на второй энергетический уровень (серия Бальмера, где излучаются фотоны видимого света) и на третий уровень (серия Пашена, ближний инфракрасный диапазон). На схеме показано, как электроны спускаются между энергетическими уровнями и излучают фотоны. Если электрон был на энергетическом уровне n = 3 и опустился на энергетический уровень n = 2, то он испустит фотон H? (серия Бальмера) с энергией 1,9 эВ.
Предоставлено Майклом Строссом
(Теперь у атома появился заряд, и это уже не атом, а ион.) Энергия ускользнувшего электрона выше нуля; она преобразуется в кинетическую энергию движения, при помощи которой электрон вырывается из атома. Как вы, возможно, уже догадались, атом может ионизироваться и в том случае, если в него врежется другой атом.
Теперь, имея представление об энергетических уровнях, мы понимаем, как светится звезда, имеющая температуру 10 000 К. При температуре 10 000 К она настолько горяча, что у небольшой, но значительной доли атомов водорода электроны окажутся в первом возбужденном состоянии n = 2. Вот почему я выбрал звезду именно с такой температурой – она максимально наглядно иллюстрирует ситуацию, которую я собираюсь описать. Глубоко внутри звезды складывается спектр теплового излучения, красивая кривая Планка. Она пытается проявиться во внешних слоях звезды; этот сплошной тепловой спектр в 10 000 К выдавливает атомы водорода в верхние слои, причем некоторые электроны в этих атомах находятся в первом возбужденном состоянии; это голодные электроны. Можно спросить: сколько энергии у отдельных фотонов в таком тепловом спектре? Энергии многих из этих фотонов соответствуют видимой части спектра, просто так сложилось. И в водороде, разогретом до 10 000 К, есть атомы с голодными электронами, расположеными на энергетическом уровне n = 2; эти электроны, как бешеные, глотают подходящие фотоны, а после этого поднимаются на более высокие энергетические уровни.
Но поглощаются не все фотоны, а лишь те, чья длина волны позволяет электрону подняться на строго определенный энергетический уровень. Например, электрон на уровне n = 2 (с энергией –3,4 эВ) может поглотить фотон, энергии которого как раз хватает для перехода на уровень n = 3 (это энергия –1,5 эВ; см. рис. 6.2). Разница потенциалов между двумя этими энергетическими уровнями составляет 1,9 эВ. Именно столько энергии нужно электрону для перехода со второго на третий энергетический уровень. Такой электрон поглотит фотон с энергией 1,9 эВ. Такой фотон обозначается H?. Длина его волны составляет 6563 ангстрем, или 656,3 нанометра, а цвет его волны – темно-красный. Фотон изымается из спектра, проталкивая при этом электрон со второго на третий энергетический уровень. Поскольку это происходит сразу с множеством электронов, в планковском спектре возникает провал, соответствующий длине волны 6563 ангстрем; он называется линией поглощения H-альфа (H?). Фотоны с длиной волны 4861 ангстрем могут поднять электрон со второго на четвертый уровень; возникает другой провал под названием линия поглощения H-бета (H?). Есть и другие такие линии: H-гамма (H?) на 4340 ангстрем, H-дельта (H?) на 4102 ангстрем и так далее; фотоны с такими длинами волн изымаются из спектра, поднимая электроны с энергетического уровня n = 2 на уровни n = 5, n = 6,… Получается сплошной спектр, так называемый спектр поглощения, в котором выбиты узкие линии на уровне тех фотонов, что поглощаются наиболее активно. Такие глубокие расщелины в спектре именуются линиями поглощения. Вся группа этих линий называется серией Бальмера: H?, H?, H?, H?, H?, далее H6, H7, H8 (никто не собирается запоминать столько греческих букв). Пространство между этими линиями соответствует различиям в разнице потенциалов на лестничной диаграмме. На рис 6.3 показан спектр звезды с поверхностной температурой 10 000 К. На вставке крупным планом показана коротковолновая часть спектра.

Рис. 6.3. Звездный спектр, в котором показаны линии поглощения серии Бальмера. Спектр звезды A, зафиксированной проектом «Слоановский цифровой обзор неба», содержит линии поглощения водорода из серии Бальмера; они называются H?, H?, H? и так далее. Линии наиболее густо расположены в районе самых коротких волн; во вставке крупным планом показан спектр, в котором обозначены линии вплоть до H10 (после H? принято использовать цифры, а не греческие буквы). Есть еще одна линия, связанная с присутствием слегка ионизированного кальция; она обозначена «Ca».
Материал лаборатории Слоановский цифровой обзор неба», предоставлено Майклом Строссом
Если рассмотреть звезду, поверхность которой немного жарче, скажем 15 000 К, то ситуация драматически меняется: при пинке электрон получает такое количество энергии, что вообще улетает из атома водорода. Электроны и протоны летают по отдельности друг от друга, атомы становятся ионизированными. В ионизированном водороде нет дискретных энергетических уровней, поэтому он перестает поглощать фотоны из серии Бальмера. Вот почему серия Бальмера четко просматривается в звездах с температурой 10 000 К, но не в более горячих звездах.
До сих пор мы обсуждали лишь водород. Однако свои роли в этом процессе играют и кальций, и углерод, и кислород, и другие элементы. Обращусь к моей любимой аналогии – к дереву. Внешний уровень звезды можно уподобить дереву. Знаете, что летит к этому дереву (из недр звезды)? Ореховая смесь. В недрах звезды установлена пушка, стреляющая в дерево разными орешками (фотонами, имеющими разную частоту), а на дереве живут белки. Моим белкам нравятся желуди (фотоны H?). Они видят этот шквал орехов, но выбирают из них только желуди; поэтому из звезды вылетает ореховая смесь, но без желудей (тепловое излучение минус фотоны H?). Допустим, на дереве живут и другие грызуны: бурундуки, которые любят орех-макадамию. Что мы имеем на выходе? Ореховую смесь без желудей и макадамии. Если на дереве будет обитать множество разных грызунов и каждый вид предпочитает конкретный вид орехов, то можно логически догадаться, кто живет на дереве, если изучить, каких орехов не хватает на выходе, то есть какие орехи поедаются на этапе пролета через крону (если знать, кто чем питается).
Именно с такой проблемой мы сталкиваемся в астрофизике. Поскольку мы не можем проникнуть в звезду (там слишком жарко), мы анализируем ее издалека, наблюдая, какой свет изымается из сплошного теплового спектра. Мы рассматриваем этот спектр и спрашиваем: совпадает ли он с линиями водорода? В основном да, но там есть и другие элементы. Идем в лабораторию, исследуем кальций, другие элементы, проверяем, свет с какими частотами они поглощают в лабораторных условиях. Затем проверяем каждый элемент – укладывается ли он в систему спектральных линий данной звезды; ведь каждый элемент оставляет характерные именно для него «отпечатки пальцев». Такие энергетические уровни, лестничные диаграммы, уникальны для каждого элемента и молекулы. (Например, на рис. 6.3 показана линия поглощения, присущая кальцию, дополнительно к линиям поглощения водорода.)
Чтобы пример получился более универсальным, давайте рассмотрим не звезду, а газовое облако в межзвездном пространстве. Это облако из водорода, обладающее сплошным энергетическим спектром благодаря тому, что его освещает расположенная поблизости яркая звезда. Свет звезды попадает в облако и выходит из него с другой стороны, поэтому в облаке складывается спектр поглощения, в котором не хватает некоторых линий. Теперь нужно каким-то образом учесть энергию. Поглощается свет, волны которого имеют такую длину, и электроны поднимаются на более высокие энергетические уровни. Эти электроны также могут падать на более низкие энергетические уровни, излучая при этом фотоны. Следовательно, между электроном и фотоном возникает краткосрочная связь. Когда электрон возвращается на исходный энергетический уровень, в случайном направлении улетает точно такой фотон, как и тот, который ранее был поглощен этим электроном. Представьте себе, что у белок и бурундуков несварение желудка, и они отрыгивают во все стороны только что проглоченные орехи. Если газовое облако находится в равновесии и среднее количество электронов на втором энергетическом уровне со временем не изменяется, то количество съеденных и отрыгнутых орехов должно быть равным. Если вы стоите на линии огня ореховой пушки (смотрите на звезду вдоль луча зрения), то заметите, как на вас летит густой поток разнообразных орехов, в которых, однако, нет желудей и макадамии. Однако если бы вы стояли в произвольной точке и смотрели на дерево, а не на линию огня (то есть располагались относительно звезды не вдоль луча зрения), то увидели бы, как с дерева вылетают желуди и макадамия. Это были бы яркие линии эмиссионного спектра как раз на тех длинах волн, которые в предыдущем примере поглощались. Из этого следует вывод, что на дереве живут белки и бурундуки. Аналогично, по линиям эмиссионного спектра, выходящим из газового облака, можно отчасти узнать, из каких элементов оно состоит. На рис. 6.4 показан снимок туманности Розетка – видно, что эта туманность красная. Газ лучится светом на эмиссионной линии водорода-альфа (H?) с длиной волны 6563 ангстрем. Итак, в этом облаке содержится водород. Астрономы получают превосходные снимки таких эмиссионных туманностей, как Розетка, используя фильтр, пропускающий свет только с длиной волны H?. Такой фильтр практически полностью блокирует засветку – свет, возникающий в результате рассеяния в земной атмосфере. Свет молодых и ярких голубых звезд, расположенных в центре туманности Розетка (они хорошо заметны на рисунке), закидывает атомы водорода на энергетический уровень n = 3, и при падении обратно на уровень n = 2 они во всех направлениях излучают фотоны с длиной волны H?. Поэтому туманность сияет красным светом H?. По тому же принципу некоторые неоновые рекламы сияют оранжевым.
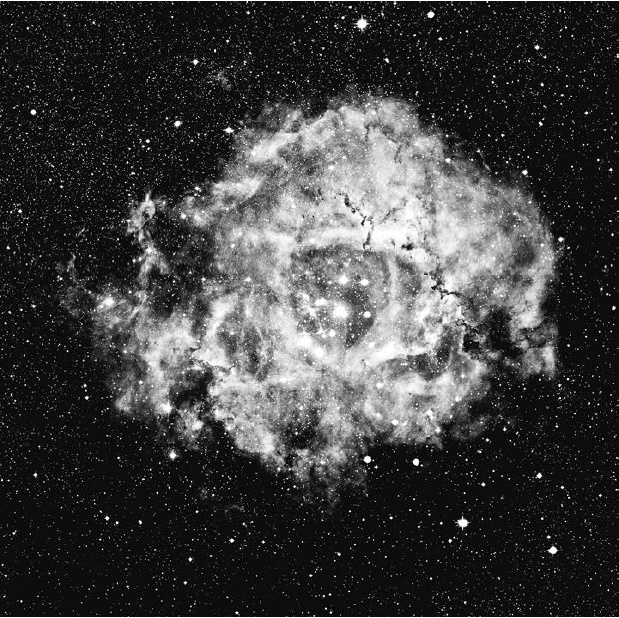
Рис. 6.4. Туманность Розетка – газовое облако, в котором образуются звезды. Красный цвет обусловлен излучением водорода, в частности, переходом c n = 3 на n = 2 (H?). Предоставлено Робертом Дж. Вандербеем
Мы обсуждаем совокупность переходов водорода H?, H?, H?, H?, так называемую серию Бальмера. Эта серия переходов была открыта в 1885 году и названа в честь исследовавшего их Иоганна Якоба Бальмера. Неважно, в какую сторону нарисовать острие стрелки на схеме энергетических уровней, – речь идет об одном и том же фотоне, входящем или исходящем. Он может быть поглощен (вверх) или излучен (вниз), но у всех переходов в серии Бальмера первое возбужденное состояние (основание) – это n = 2, и соответствующие фотоны относятся к видимой части спектра (см. рис. 6.2 – там показана эмиссия фотонов при переходе электронов на нижние энергетические уровни). Именно потому, что эти фотоны находятся в видимой части спектра, серия Бальмера была открыта раньше других. Но есть еще две подобные серии. Одна из них называется серией Пашена, ее основное состояние – n = 3. В ней масштаб энергетических переходов меньше, поэтому энергия у всех фотонов этой серии ниже, чем у фотонов видимого спектра (см. рис. 6.2). Серия Пашена целиком относится к инфракрасному спектру. После того как появились хорошие детекторы для надежного измерения инфракрасного излучения, обнаружилась и серия Пашена. Следует учитывать, что есть и другие подобные семейства, но я упомяну всего три серии: Пашена, Бальмера и еще одну, серию Лаймана (как и выше, в соответствии с греческой номенклатурой выделяются Лайман-альфа, Лайман-бета и так далее). Основное состояние этой серии – n = 1, все эти переходы относятся к ультрафиолетовому спектру. Самый низкоэнергетический переход в серии Лаймана обладает большей энергией, чем самый высокоэнергетический в серии Бальмера (вновь отсылаю вас к рис. 6.2).
Соответственно когда мы рассматриваем такие переходы, серия Бальмера обособлена от остальных серий, серия Лаймана обособлена от остальных и серия Пашена также обособлена от остальных, поэтому их легко изолировать и понять. Я мог бы нарисовать атом, в котором все было бы не так просто. Я мог бы «сконструировать» атом – в мире немало странных атомов, – в котором энергетические переходы и три серии, Лаймана, Бальмера и Пашена, были бы похожи, три эти семейства в спектре перекрывались бы. Размышляя об этих линиях и о том, как определять их для еще не открытых элементов, возможность существования такого атома нельзя сбрасывать со счетов.
На протяжении нескольких тысяч лет мы могли измерить лишь яркость звезды, ее положение в небе и, может быть, отметить ее цвет. Такова была классическая астрономия. Она превратилась в современную астрофизику, когда мы начали определять звездные спектры, ведь спектры позволяют понять химический состав звезд, а точная интерпретация спектра возможна благодаря квантовой механике. Я хотел бы подчеркнуть, насколько это важно. Мы не понимали спектров до того, как была разработана квантовая механика. Планк ввел свою постоянную в 1900 году, а в 1913 году Бор предложил свою модель атома водорода, положение электронов и орбиталей в которой было объяснено при помощи квантовой механики. Это позволило объяснить серию Бальмера. На самом деле, современная астрофизика началась только после этого события, в 1920-е годы. Подумайте, насколько недавно это было. Сегодня еще живы старики, родившиеся на заре существования астрофизики. Тысячелетиями люди, в сущности, не имели никакого понятия о звездах, но за срок всего одной человеческой жизни мы исследовали звезды достаточно хорошо. У меня есть книга по астрономии, вышедшая в 1900 году, и материал в ней изложен на уровне «вот созвездие», «вот красивая звезда», «там много звезд», «а здесь звезд меньше». Там есть целая глава о фазах Луны, глава о солнечных затмениях – вот и все, о чем могли рассуждать астрономы. Однако в научных книгах, написанных после 1920-х годов, уже идет речь о химическом составе Солнца, источниках ядерной энергии, судьбе Вселенной. В 1926 году Эдвин Хаббл открыл, что Вселенная обширнее, чем кто-либо мог подумать, – ведь он обнаружил, что другие галактики находятся гораздо дальше, чем звезды нашего Млечного Пути. В 1929 году он же открыл, что Вселенная расширяется. Эти эпохальные открытия произошли при жизни людей, некоторые из которых живы еще сегодня. Потрясающе. Иногда я задаюсь вопросом: а какие революции ждут нас в следующие несколько десятилетий? Свидетелями каких космологических открытий окажетесь вы – и сможете рассказать о них своим потомкам?
Учитывая такие уроки истории, просто старайтесь не делать таких идиотских прогнозов, как французский философ Огюст Конт, который в своей книге «Положительная философия», вышедшей в 1842 году, заявил о звездах следующее: «Мы никогда не сможем определить ни их химический состав, ни, в случае некоторых из них, как теплота поглощается их атмосферой».
| <<< Назад Глава 5 Как звезды излучают энергию (II) |
Вперед >>> Глава 7 Жизнь и смерть звезд (I) |
- Глава 1 Размер и масштабы Вселенной
- Глава 2 От дневного и ночного неба к орбитам планет
- Глава 3 Законы Ньютона
- Глава 4 Как звезды излучают энергию (I)
- Глава 5 Как звезды излучают энергию (II)
- Глава 6 Звездные спектры
- Глава 7 Жизнь и смерть звезд (I)
- Глава 8 Жизнь и смерть звезд (II)
- Глава 9 Почему Плутон – не планета
- Глава 10 Поиски жизни в Галактике
- Таблица 4.1. Кеплеровские элементы орбиты и звездные величины комет, MOID которых меньше 0,1 а.е.
- 81. Что такое рассеянные и шаровые звездные скопления?
- Шаровые звездные скопления, «космические мафусаилы»
- Глава I Звездные имена
- Звездные войны
- ЗВЕЗДНЫЕ АТЛАСЫ И КАРТЫ
- 1. Большая Медведица — это звездные часы
- № 52 Плеяды, Гиады и Шкатулка Драгоценностей. Открытые звездные скопления
- № 1 И дольше года длится день… Звездные и солнечные сутки
- 4.2. Физические характеристики, строение ядра
- 85. Кто наши ближайшие галактические соседи?
- Столкновение галактик
