Книга: Происхождение жизни. От туманности до клетки
Структуры и функции белков
| <<< Назад История аминоацил-тРНК-синтетаз |
Вперед >>> Древняя история белков записана в рибосоме |
Структуры и функции белков
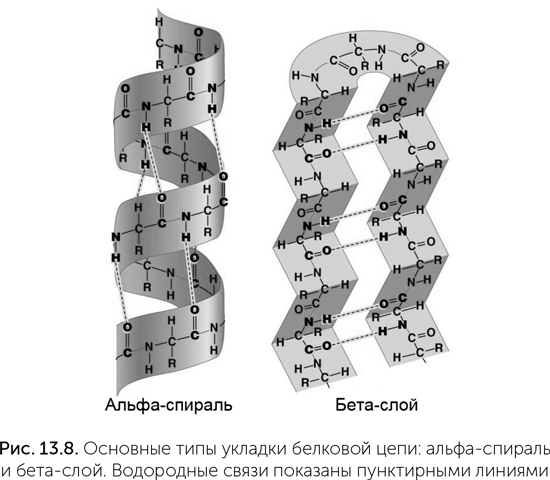
Большинство белков в клетках – водорастворимые, компактно свернутые молекулы. Укладка белковой цепи определяется порядком полярных и неполярных аминокислот в ней. Белки сворачиваются так, чтобы полярные аминокислоты находились на поверхности и контактировали с водой, а неполярные были скрыты внутри и контактировали друг с другом. Кроме того, цепь аминокислот благодаря водородным связям между C=O и N-H группами остова может образовать два типа упорядоченных структур: альфа-спираль и бета-слой (рис. 13.8). В альфа-спирали белковая цепь закручена вправо, на один оборот спирали приходится 3,6 аминокислот, и водородные связи образуются между соседними витками – через три аминокислоты. В бета-слое белковая цепь сложена в несколько параллельных прямых участков, и водородные связи образуются между соседними прямыми фрагментами цепи.
Эксперименты с искусственными белками показали, что пространственная укладка определяется в основном чередованием полярных и неполярных аминокислот в цепи. Так, для бета-слоя на поверхности белка нужно чередование «один через один» – АВАВАВАВ, так, чтобы все полярные группы аминокислот смотрели в одну сторону, а неполярные – в другую. Для альфа-спирали требуется повторение 7-аминокислотных фрагментов ААВВАВВ или АААВААВ, тогда одна сторона спирали будет полярной и обращенной к воде, а другая – неполярной внутренней.
Пять неполярных аминокислот (валин, лейцин, изолейцин, фенилаланин, метионин) в значительной степени взаимозаменяемы между собой. Глицин и пролин стоят особняком, они не вписываются ни в альфа-спираль, ни в бета-слой и находятся в местах крутых поворотов белковой цепи между спиралями или между прямыми участками бета-слоя. 13 остальных аминокислот полярны и если обращены в воду, то тоже практически взаимозаменяемы. Таким образом, для расчетов трехмерной укладки белка можно в первом приближении считать, что аминокислот не 20, а только 3 – «полярная», «неполярная» и «поворотная». Это резко увеличивает вероятность получить белок с нужной укладкой случайным перебором: для белка из 100 аминокислот возможны 20100 вариантов последовательности, что намного больше числа частиц в видимой Вселенной. Но с точки зрения укладки вариантов только 3100 (приблизительно 1045), а осмысленных (с альфа-спиралями и бета-слоями) еще на много порядков меньше из-за необходимых для этого простых чередований аминокислот.
Эксперименты показывают, что коль скоро белок компактно свернут, то наличие у него какой-нибудь ферментативной активности – правило, а не исключение. Более того, активностей может быть несколько даже у короткого белка!
В опытах группы Майкла Хехта из Принстона изучались искусственные белки, складывающиеся в пучок из четырех альфа-спиралей (такую укладку имеют, например, цитохромы b – белки для переноса электронов и ферритины – белки для хранения железа). Ученые создавали на компьютере кодирующие последовательности для белков длиной 74 аминокислоты. 18 аминокислот между спиралями были всегда одинаковы и включали пролин и глицин, а альфа-спирали составлялись из 24 неполярных позиций (в каждой мог быть валин, лейцин, изолейцин, фенилаланин, метионин) и 32 полярных (в каждой могла быть одна аминокислота из шести: глутаминовая кислота, аспарагиновая кислота, лизин, гистидин, аспарагин, глутамин). При таких ограничениях возможно примерно 1041 вариантов последовательностей. Для 48 случайно выбранных виртуальных белков были синтезированы кодирующие их гены, вставлены в клетки кишечной палочки, и синтезированные белки удалось выделить и изучить. 60 % из них были компактно свернуты в пучки из четырех спиралей. Среди компактно свернутых белков половина связывала гем, подобно настоящим цитохромам, а 4 из 29 проявляли пероксидазную активность (т. е. окисляли субстраты с использованием перекиси водорода). Лучшая из четырех пероксидаз из этой случайной библиотеки лишь в 3,5 раза уступает по активности природным пероксидазам, прошедшим отбор!
В ходе дальнейших экспериментов была создана библиотека 400 случайных 4-спиральных белков длиной 102 аминокислоты. Из них более 90 % компактно сворачивались, 60 % связывали гем, 50 % проявляли пероксидазную активность. Кроме того, эти белки были проверены на другие ферментативные активности в отсутствие гема. Оказалось, что 30 % проявляют эстеразную активность[10], а 20 % – липазную. 3 % белков в этой библиотеке проявляли все три ферментативные активности, на которые их проверяли! (Patel et al., 2009).
В еще более масштабном поиске более миллиона 4-спиральных 102-аминокислотных белков были проверены на способность заменять природные ферменты кишечной палочки. Кодирующие их гены встраивали в штамм, лишенный необходимого фермента, и проверяли, возвращают ли они бактериям способность расти на минимальной питательной среде. Из 27 удаленных природных ферментов в библиотеке нашлись аналоги для четырех: фосфосерин-фосфатазы, цитрат-синтазы, треонин-деаминазы и энтерин-эстеразы (Fisher et al., 2011).
Эти данные показывают, что коль скоро белок свернут, то какая-нибудь ферментативная активность у него с высокой вероятностью будет. Более того, похоже, что эволюция современных белков ограничена в первую очередь опасностью появления новых нештатных функций, а не опасностью утраты основной функции. Поэтому, например, белки, работающие в митохондриях, эволюционируют в несколько раз быстрее, чем в среднем по клетке, даже если они кодируются ядерным геномом (подробнее о митохондриях – в главе 18). Ведь в митохондриях низкое разнообразие белков и мало потенциальных партнеров для нештатного связывания.
| <<< Назад История аминоацил-тРНК-синтетаз |
Вперед >>> Древняя история белков записана в рибосоме |
- Синтез белка в клетках
- Происхождение транспортных РНК
- История рибосомных РНК
- История генетического кода
- История аминоацил-тРНК-синтетаз
- Структуры и функции белков
- Древняя история белков записана в рибосоме
- Обойденные и вымершие аминокислоты
- «Рабочий код» и происхождение генетического кода
- Порядок развития белкового синтеза и генетическом кода
- 2.3.3. Белки, их строение и функции
- Белоксинтезирующие структуры и время
- ОТ СТРУКТУРЫ К ФУНКЦИИ (функциональная геномика)
- Роль изменения структуры и функции мембран клетки
- Научное исследование мозга, мышления и поведения
- 8. Органические вещества. Углеводы. Белки
- Проверьте свои знания
- Прямоугольные решетки
- От конкретного к абстрактному
- Параллельные и расходящиеся
