Книга: Энергия жизни. От искры до фотосинтеза
Глава 17. СЛАБОЕ ПРИТЯЖЕНИЕ
| <<< Назад Глава 16. ПОДРОБНЕЕ О БЕЛКАХ |
Вперед >>> Глава 18. КАК РАБОТАЮТ ФЕРМЕНТЫ |
Разделы на этой странице:
Глава 17.
СЛАБОЕ ПРИТЯЖЕНИЕ
Можем ли мы быть уверены, что одного лишь большого размера достаточно, чтобы молекула оказывалась столь непрочной? Очевидно, это не так, если взять для примера хоть молекулу целлюлозы — она очень велика, но при этом очень прочна. Да и полипептидная цепочка не обладает повышенной хрупкостью по сравнению с другими длинными молекулярными цепочками, поскольку нам известны белки, состоящие из цепочек аминокислот, связанных пептидными связями, еще менее хрупкие, чем молекулы целлюлозы.
Лучшим примером такого вещества является белок фиброин, имеющий довольно простую для белка структуру. Пять шестых всех составляющих его аминокислот — это глицин, аланин и серии, имеющие самое простое строение. Другие аминокислоты представлены слабо, а пять — отсутствуют вообще. И все же фиброин — это белок, который состоит из аминокислот, скрепленных вместе пептидными связями. Нам это вещество знакомо в первую очередь по волокнам. Оно является главной составляющей шелка. А поскольку шелковая лента прочнее, чем хлопчатобумажная (состоящая по большей части из целлюлозы), то приходится признать, что полипептидная цепочка сама по себе еще не является залогом хрупкости.
И тем не менее факт остается фактом: большинство белковых молекул, в том числе — все ферменты, хоть и состоят из тех же компонентов, что и фиброин, и скреплены воедино теми же связями, все же претерпевают необратимые изменения под воздействием достаточно слабого нагревания. Парадокс: одни и те же составляющие, скрепленные одним и тем же образом, могут оказаться и прочными, как шелк, и хрупкими, как яичный белок.
Более того, получается, что те перемены, благодаря которым сырой яичный белок превращается в твердое белое вещество яичного белка, сваренного вкрутую, не затрагивают ни аминокислот, ни связей между ними — по крайней мере, тех, которые я описал. Тепла, достаточного для того, чтобы сделать яйцо твердым, а фермент — неактивным, оказывается явно мало для того, чтобы разорвать пептидную связь. В денатурированном белке (то есть таком, который не способен более выполнять свои биологические функции) присутствуют все те же пептидные цепочки, состоящие из тех же аминокислот, что и в исходном белке до нагревания.
Разумеется, мы не можем принять представление о том, что тут имеет место что-то мистическое, лежащее вне рациональных законов природы. Если свойства денатурированного яичного белка отличаются от свойств исходного яичного белка, то, значит, между этими двумя веществами есть какая-то разница. Раз молекула белка денатурируется и при этом не разрывается ни одна связь между ее атомами, значит, существуют какие-то более слабые связи, при этом жизненно важные для сохранения особых свойств молекулы, которые разрушаются под воздействием слабых изменений окружающей среды, приводя тем самым к денатурации.
Такое предположение подтверждается и тем фактом, что иногда в денатурированных белках обнаруживаются сочетания белков, не встречающиеся в исходных белках. Чаще всего в этих сочетаниях встречается так называемая «меркаптановая группа», состоящая из атома серы и атома водорода (-S-H) (рис. 25). Она содержится в присутствующей практически во всех белках аминокислоте — цистеине.
Некоторые химические вещества могут вступать в соединение с меркаптановой группой, образуя вещество, выпадающее в виде осадка или растворяющееся, но обладающее при этом характерным цветом. (Химические вещества, используемые для обнаружения определенных атомов или сочетаний атомов с помощью облегчения их визуализации, называются «тестовыми реагентами».) Даже если сам цистеин связан в пептидной цепи, его радикал с меркаптановой группой остается свободным, и те же самые тестовые реагенты, которые вступают в реакцию с чистым цистеином, будут реагировать и с пептидной цепочкой, содержащей цистеин.
Однако многие белки, в состав которых цистеин явно входит (поскольку обнаруживается среди смеси аминокислот, на которые белок распадается под воздействием кислоты), сами по себе в реакцию с тестовыми реагентами не вступают. А вот после денатурации — запросто.
Проще всего предположить, что в природном белке пептидная цепочка имеет такую форму, при которой радикалы части составляющих ее аминокислот направлены не «наружу», а в некую «внутреннюю полость» молекулы. Если эти аминокислоты — цистеин, а следовательно, эти «изолированные» от внешней среды радикалы — меркаптан, то тестовые реагенты просто не могут дотянуться до него, чтобы вступить в реакцию. А после денатурации пептидная цепочка раскрывается, и тестовые реагенты получают доступ к меркаптановой группе.
В процессе денатурации разрушается упорядоченность трехмерной формы пептидной цепочки. Ее звенья принимают произвольное положение в пространстве. Такому увеличению беспорядка соответствует значительное увеличение энтропии. А вот для проведения обратного процесса — формирования искусно сложенного естественного белка из денатурированного — требуется уже уменьшать энтропию, а значит, подобная «ренатурация» практически невозможно (разве что на самой первой стадии процесса). Чтобы можно было представить это положение наглядно — ренатурацией был бы процесс «разваривания» яйца, сваренного вкрутую, обратно в живое яйцо.
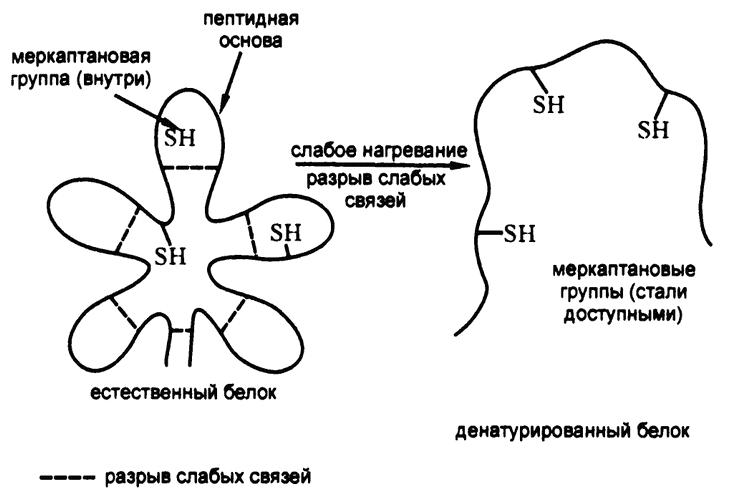
Рис. 25. Денатурация пептидной цепочки
Значит, изначальная пептидная цепочка поддерживается в «нужной» форме с помощью неких химических связей, и эти связи настолько слабы, что даже незначительное изменение условий способно их разрушить и тем самым денатурировать белок.
Перед тем как перейти к обсуждению природы этих слабых связей, на которые мы и возложим ответственность как за хрупкость белков, так и за особые свойства ферментов, мне придется сделать небольшое отступление и поговорить о природе химических связей как таковых. Мне придется повторить часть уже сказанного в главе 10, но сейчас подробностей будет гораздо больше.
С самого момента зарождения теории атомов стало ясно, что должна существовать какая-то сила, которая удерживает разные атомы в составе одной молекулы. Более того, тот образ, которым эта сила себя проявляет, оказался индивидуальной характеристикой каждого элемента. К примеру, выяснилось, что один атом водорода никогда не может присоединять к себе более одного чужого атома, один атом кислорода — больше двух других атомов, один атом углерода — больше четырех и так далее.
В 1852 году английский химик Эдуард Франкленд предложил назвать эту способность атомов словом «валентность» (от латинского слова, означающего «способность»). То есть валентность водорода — 1, как и фтора, хлора, брома, йода, натрия и калия. Валентность кислорода — 2, и такой же валентностью обладают сера, магний и кальций. Валентность азота — 3, и в эту же группу входят фосфор, мышьяк и алюминий. Валентность углерода и кремния — 4.
Валентность одного и того же элемента не обязательно всегда одна и та же. К примеру, валентность углерода — в принципе 4, но иногда он имеет валентность 2. Валентность азота — вообще 3, но бывает, что и 5. Валентность железа — 2 или 3; золота — 1 или 3; меди и ртути — 1 или 2 и так далее.
В отношении достаточно простых неорганических веществ вопрос о валентностях не влияет на вид уже устоявшихся формул. Так, железо может соединяться с хлором двумя различными способами. Один атом железа может вступать в соединение как с двумя (дихлорид железа, FeCl2) атомами хлора, так и с тремя (трихлорид железа, FeCl3). В обоих случаях из формулы понятно, с каким именно соединением мы имеем дело, и видно, что в первом случае валентность железа — 2, а во втором — 3.
Однако при переходе к значительно более сложным органическим соединениям введение понятия валентности произвело жизненно необходимую революцию в деле написания формул. Уже в начале XIX века стало ясно, что традиционная схема для органической химии не годится, потому что выяснилось, что совершенно различные вещества могут иметь один и тот же атомный состав.
Первым это обнаружил, к собственному изумлению, немецкий химик по имени Юстус фон Либиг, выделивший в 1823 году вещество, названное им «гремучим серебром». Фон Либиг установил, что молекула этого вещества состоит из четырех атомов — по одному атому серебра, углерода, азота и кислорода. И оказался в недоумении — дело в том, что вещество точно с таким же атомным составом было на тот момент хорошо известно, носило название «изоцианат серебра» и имело абсолютно другие свойства.
Об этом рассказали Берцелиусу, но он отказывался верить услышанному до тех пор, пока сам не открыл два вещества с одинаковым атомным составом, но разными свойствами. Берцелиус назвал такие «родственные» вещества «изомерами», но природа изомерии, как явления, так и осталась на тот момент загадкой.
Ключом к решению стало введенное Франклендом понятие валентности. В 1859 году немецкий химик Фридрих Август Кекуле первым использовал графическое выражение записи формул с учетом валентности каждого элемента. Вот так выглядели в новой записи формулы таких хорошо известных веществ, как вода (H2O), метан (СН4), углекислота (CO2), аммиак (NH3) и хлороводород (HCl):
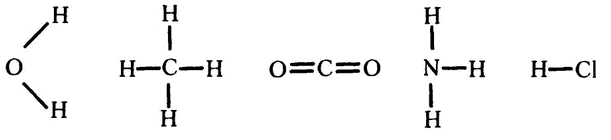
В составе всех этих веществ атомы водорода (Н) и хлора (Cl) всегда имеют только одну связь, атом кислорода (О) — две, азота (N) — три, углерода (С) — четыре. Эта же система доказала свою работоспособность и в применении к более сложным органическим веществам, таким как сахароза или триптофан. Такая запись получила название «структурная формула», а для записей старого типа, вроде СН4, был принят термин «эмпирическая формула».
Практически сразу стало ясно, что одни и те же атомы вполне можно соединить по-разному, не нарушая законов валентности. Рассмотрим пример первой открытой пары изомеров. Вот как выглядит структурная формула гремучего серебра:
Ag—N=C=O.
(Ag — это обозначение серебра, от латинского «argentum».) А структурная формула изоцианата серебра выглядит так:
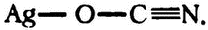
Как видно, в обоих случаях валентность атома серебра остается равной 1, кислорода — 2, азота — 3, а углерода — 4.
В более сложных органических соединениях количество вариантов соединения молекул без нарушения принципа валентностей увеличивается многократно и доходит до фантастических величин. К примеру, подсчитано, что с использованием 40 атомов углерода и 82 атомов водорода можно составить более шестидесяти триллионов разных вариантов молекулы.
Вот уже более ста лет химики руководствуются системой Кекуле при составлении возможных вариантов строения новой молекулы и числа ее возможных изомеров. С тех пор, конечно, система во многом была доработана и стала более гибкой, но в основном она все та же и, похоже, останется такой и в обозримом будущем.
Главным недостатком системы валентностей в глазах химиков середины XIX века была ее условность. С чего бы это у кислорода валентность 2, у углерода — 4, а у водорода — только 1? А вот у водорода, натрия и хлора — валентность одинаковая, а все остальные свойства — совершенно разные?
На поверку система валентностей оказалась не такой уж и условной, и доказал это русский химик Дмитрий Иванович Менделеев. В 1869 году он выписал все известные элементы в порядке возрастания атомного веса и наглядно показал, что изменение их свойств в таком расположении подчиняется определенным законам. Расписав все элементы в двухмерной матрице, где элементы со схожими свойствами оказались сгруппированными в столбцы, он получил то, что всем нам сейчас известно как «таблица Менделеева»[5]. В частности, оказалось, что внутри каждого столбца все элементы имеют одинаковую валентность (рис. 26).
К примеру, одновалентные фтор, йод, хлор и бром оказались в одном столбце таблицы; двухвалентные магний, кальций, стронций и барий тоже оказались собранными в одном столбце. Точно так же в одном столбце очутились демонстрирующие валентность 3 или 5 азот, фосфор, мышьяк и сурьма и так далее.
Если же проследить не столбцы, а строки таблицы, то оказывается, что внутри всех строк валентность изменяется одинаковым образом. Взять, к примеру, вторую строку (первую из полных строк таблицы): в порядке возрастания атомного веса в ней перечислены литий, бериллий, бор, углерод, азот, кислород и фтор. Соответственно, валентности этих элементов — 1, 2, 3, 4, 3 (или 5), 2 и 1.
Изобретение периодической таблицы Менделеева стало одной из величайших побед химической теории, заставив ученый мир признать валентность логически неотъемлемым свойством элементов, хотя механизм химических связей все еще продолжал оставаться загадкой.
Затем, примерно в конце века, было обнаружено, что и атом имеет собственное внутреннее строение. Стало известно, что в нем содержатся электроны. Выяснилось, что в середине атома находится крошечное ядро, имеющее положительный заряд, а все остальное пространство атома заполнено облаком отрицательно заряженных электронов, вращающихся вокруг ядра. Ядро атомов каждого элемента характеризуется свойственной только ему величиной заряда. Ядро атома водорода несет минимально возможный заряд, произвольно принятый за 1. Заряд ядра атома углерода в шесть раз больше, поэтому его значение оценивается как 6. Таким же образом значение заряда ядра атома азота принимается за 7, а ядра атома кислорода — за 8. Для всех возможных значений от 1 до 103[6] можно найти свой элемент.
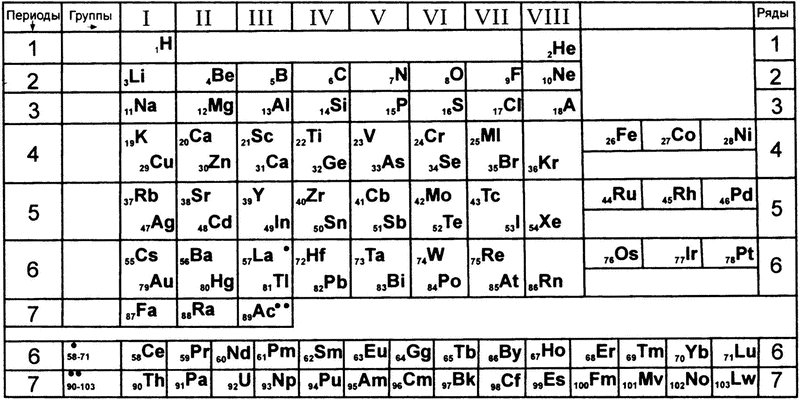
Рис. 26. Таблица Менделеева
В идеале свободный атом имеет ровно столько электронов (заряд каждого из которых равен -1), чтобы уравновешивать положительный заряд ядра. Так, в атоме водорода — 1 электрон, в атоме углерода — 6, в атоме азота — 7, в атоме кислорода — 8 и так далее.
Электроны распределяются по оболочкам, в каждой из которых может содержаться не более определенного их количества. Во внутренней, самой близкой к ядру, оболочке может находиться только 2 электрона, в следующей — уже 8, в следующей — 18 и так далее. Так, если атом углерода имеет 6 электронов, то они должны быть распределены по двум оболочкам — 2 во внутренней и оставшиеся 4 — во внешней. А у атома хлора — 17 электронов, значит, они должны быть распределены уже между тремя оболочками — 2 во внутренней, 8 в средней и оставшиеся 7 — во внешней.
Теперь все закономерности таблицы Менделеева становятся понятны. Взять, к примеру, седьмой столбец: первым в нем идет атом фтора — его 9 электронов поделены между двумя оболочками, внешняя из которых содержит 7 электронов; затем — атом хлора, его 17 электронов поделены уже между тремя оболочками, но внешняя опять же состоит из 7 электронов; 35 электронов брома распределяются уже между четырьмя оболочками, но и тут на внешнюю оболочку приходится только 7 из них. И во внешней (пятой) оболочке йода, имеющего в своем составе 53 электрона, тоже находятся 7 электронов. Свойства этих элементов близки потому, что все они имеют по 7 электронов во внешней оболочке.
Чем глубже химики XX века проникали в предмет, тем обыденнее в химических записях становилось обозначение, при котором элемент маркируется не только обычным символом, но и количеством электронов в его внешней оболочке. К примеру, водород, обладающий всего одним электроном, обозначается как H•.
Углерод, всего имеющий шесть электронов, но во внешней оболочке — только четыре, обозначается как

В таблице 7 приведены «электронные» записи некоторых особо важных для живой материи элементов.
Что касается легких элементов, вроде перечисленных в таблице 7, самым стабильным является случай, когда во внешней оболочке находится восемь электронов. Важным исключением является гелий, имеющий всего одну оболочку с максимальным числом возможного вмещения электронов — 2. Конечно, для него самым стабильным вариантом является случай с двумя электронами во внешней оболочке.
Теперь давайте рассмотрим натрий. Его 11 электронов распределены следующим образом: 2 — во внутренней оболочке, 8 — в средней и 1 — во внешней. Если атом натрия потеряет 1 электрон, то его внешней оболочкой станет средняя, в которой как раз 8 электронов, то есть будет достигнуто стабильное положение. Поэтому атом натрия весьма склонен терять «лишний» электрон.
Таблица 7.
ЭЛЕКТРОННЫЕ ОБОЗНАЧЕНИЯ

Противоположную картину представляет собой атом хлора — его 17 электронов распределены между оболочками следующим образом: 2, 8 и 7. При таком распределении для того, чтобы внешняя оболочка имела 8 электронов, нужно, наоборот, где-то «добыть» недостающий, восьмой.
Понятно, что с такими потребностями атом натрия и атом хлора имеют прямо противоположные, дополняющие друг друга стремления. Если они случайно столкнутся, атом первого легко отдаст электрон атому последнего, и в результате оба обретут более стабильное состояние. Потеряв электрон, атом натрия потеряет и электрический баланс, ведь теперь отрицательный заряд его электронов окажется недостаточным, чтобы уравновешивать положительный заряд ядра, равный по-прежнему 11, тогда как суммарный заряд электронов атома теперь равняется всего лишь -10. Соответственно, весь атом натрия теперь является носителем общего заряда в +1, превратившись, таким образом, в положительно заряженный ион натрия, Na+.
С другой стороны, атом хлора, получив дополнительный электрон, теперь имеет 18 отрицательно заряженных электронов с суммарным зарядом, соответственно, -18, и ядро с положительным зарядом всего 17. Так что общий заряд атома хлора теперь -1, и он превратился в отрицательно заряженный ион хлора Сl-. Так в XX веке, на основании новых представлений о строении атома, был окончательно постигнут механизм формирования ионов, выдвинутый еще в XIX веке как теория, объясняющая функционирование электрической батареи (см. главу 10).
Положительно заряженный ион натрия и отрицательно заряженный ион хлора удерживаются вместе силой электростатического притяжения, существующего между разнонаправленно заряженными частицами, и в результате получается соединение NaCl. Связь, образованная таким образом, называется «ионная связь».
Понятно теперь, почему валентность натрия — 1, ведь у него есть только один электрон, избавившись от которого атом достигнет стабильности в их распределении. И понятно, почему валентность у хлора 1, поскольку для той же самой стабильности ему достаточно получить 1 атом. Вот кальцию и магнию надо будет для того же самого избавиться уже от двух электронов, поэтому и валентность каждого из них равна 2. У кислорода же во внешней оболочке 6 электронов, и для обретения стабильности ему надо присоединить 2, так что его валентность — тоже 2. Если атом кальция отдаст свои два электрона атому кислорода, то и получившийся ион кальция, Са2+, и получившийся ион кислорода, О2-, обретут стабильное состояние в составе образовавшегося вещества с сильной внутренней ионной связью, СаО (оксид кальция — негашеная известь).
Однако для образования межатомной связи совсем не обязательно, чтобы один атом отдавал свой электрон другому. Вот, например, два атома хлора — что удерживает их вместе? Каждому из них не хватает одного электрона, оба в равной степени склонны к приобретению электронов, и ни один не собирается свой электрон отдавать. В общем, невероятно, чтобы в молекуле, состоящей из двух атомов хлора, один из них вдруг поступился собственным электроном в пользу второго.
Этого и не происходит — вместо этого атомы «по-братски» формируют общий для них обоих пул электронов. Чтобы показать наглядно, как это происходит, давайте обозначим электроны одного из них как точки, а второго — как крестики. Еще раз повторюсь — это делается исключительно для удобства восприятия и ни в коем случае не должно восприниматься как свидетельство каких-либо качественных различий между электронами первого и второго атома. Насколько известно, все электроны всех атомов одинаковы. Итак, соединение двух атомов хлора в молекулу хлора можно обозначить так:
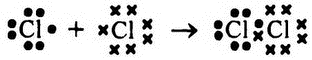
В составе молекулы хлора 2 атома хлора обладают все теми же 14 электронами внешних оболочек в сумме; никаких новых электронов в систему не добавлено. Однако 2 электрона, представленные на схеме, как находящиеся посередине между атомами (один — точкой, а второй — крестиком), одновременно принадлежат внешней оболочке и того и другого атома. Соответственно, во внешней оболочке каждого из атомов находится по 8 электронов, и состояние двухатомной молекулы гораздо стабильнее, чем состояние двух отдельных атомов. И поскольку находиться в двух внешних оболочках одновременно электроны могут только в том случае, когда атомы прижаты друг к другу, то для того, чтобы растащить атомы в стороны, то есть перевести их от более стабильного состояния к менее стабильному, требуется затратить энергию.
Другими словами, формирование молекулярного хлора из атомов хлора сопровождается снижением уровня свободной энергии и является, таким образом, спонтанной реакцией. А разложение молекулы хлора требует увеличения свободной энергии, а значит, спонтанно протекать не может.
Роль связки между атомами выполняет в данном случае пара «общих» электронов. Такая связь называется «ковалентной», и именно такую природу имеет большинство связей в органических соединениях.
Метан (СН4) с электронной точки зрения можно рассматривать как сочетание атома углерода, с его четырьмя электронами во внешней оболочке, с четырьмя атомами водорода, каждый из которых имеет единственный электрон.

Атом углерода каждый из своих электронов передает в общее пользование с одним из атомов водорода, а каждый из атомов водорода, в свою очередь, тоже предоставляет собственный электрон в общее пользование. В результате каждый атом водорода имеет по два электрона в своей единственной оболочке (которая обретает, таким образом, стабильное состояние), а внешняя оболочка атома углерода тоже получает стабильное число 8.
Правильное «обобществление» внешних электронов позволяет объяснить все факты, ранее объяснявшиеся через систему прямолинейных связей Кекуле, и, более того, через электроны оказалось возможным объяснить некоторые факты, перед которыми изначальная система формул Кекуле оставалась бессильной.
Вот, к примеру, два атома хлора, составляющие молекулу хлора, одинаковые и электроны держат одинаково крепко. Поэтому и «общие» электроны они распределяют между собой поровну. Атомы водорода и углерода тоже удерживают свои атомы с примерно равной силой, так что и в метане «общие» атомы распределены примерно поровну.
А вот в случае ковалентных связей между водородом и кислородом все несколько по-другому. Атом кислорода с атомом водорода тоже формируют «общую» пару электронов, но при этом атом кислорода, крепче удерживающий свои электроны, будет сильнее перетягивать их в свою собственную внешнюю оболочку, так что оболочке атома водорода электроны будут принадлежать в несколько меньшей степени.
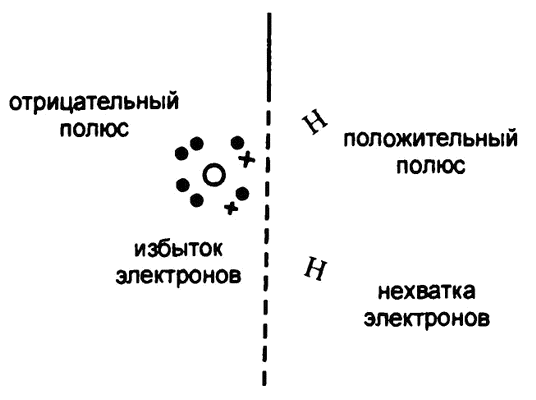
Рис. 27. Поляризованная молекула воды
А раз атом кислорода перетягивает на себя больше половины «общих» электронов, то и отрицательный заряд их большей частью придется на атом кислорода. Соответственно, атом кислорода в целом будет иметь отрицательный электрический заряд дробного значения, а «обделенный» электронами атом водорода — положительный заряд ровно такого же значения.
Соответственно, молекула воды будет обладать небольшим перекосом положительного заряда в сторону водорода и отрицательного — в сторону кислорода, как это показано на рис. 27. Молекулы, в которых наблюдается подобное, называют «полярными», поскольку полюса электрического заряда — водород и кислород — можно рассматривать в них как полюса магнита. А молекулы вроде хлора или метана, где четкой концентрации заряда на конкретных участках не наблюдается, являются «неполярными».
Электрические заряды противоположной направленности двух различных поляризованных молекул будут притягивать друг друга, так же как и противоположно заряженные ионы. Другими словами, молекулы воды в жидком состоянии этого вещества (а во льду — тем более) склонны принимать такое положение, чтобы отрицательно заряженная кислородная часть одной молекулы прилегала к положительно заряженной водородной части молекулы соседней.
Значения зарядов полярных молекул, в которых заряд одного и того же электрона просто оказывается неравномерно распределенным, — гораздо меньше, чем в тех случаях, когда речь идет о полноценной передаче электрона от одного атома к другому. Поэтому и притяжение между полярными молекулами гораздо слабее, чем ионная связь. Эти межмолекулярные притяжения на самом деле в двадцать раз слабее ковалентных связей.
Однако этого оказывается достаточно, чтобы, например, молекулы воды «липли» друг к другу и, соответственно, требовалось гораздо больше энергии на разрыв этих межмолекулярных связей (имеется в виду растапливание льда или выпаривание воды), чем для произведения тех же самых действий в отношении, например, метана.
Поэтому, хотя молекулы метана и воды имеют приблизительно одинаковые размер и сложность строения, температура плавления метана -184 °С, а воды — 0°С; а температура кипения этих веществ -161°С и +100°С соответственно.
Сильнее всего межмолекулярные силы притяжения проявляются тогда, когда в состав молекулы входит положительно заряженный атом водорода, поскольку его размеры настолько малы (водород — самый маленький атом), что он может ближе всего подойти к атомам с сильным отрицательным зарядом (например, кислороду, азоту или фтору). Поскольку известно, что электростатическое притяжение изменяется обратно пропорционально квадрату расстояния между центрами атомов, то понятно, что чем меньше расстояние, тем больше сила притяжения.
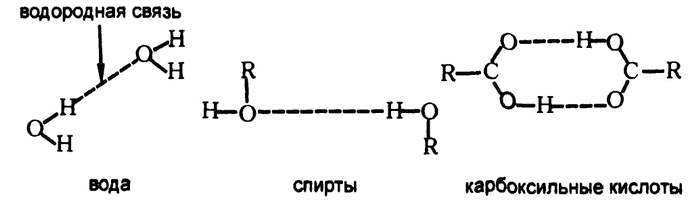
Рис. 28. Водородная связь
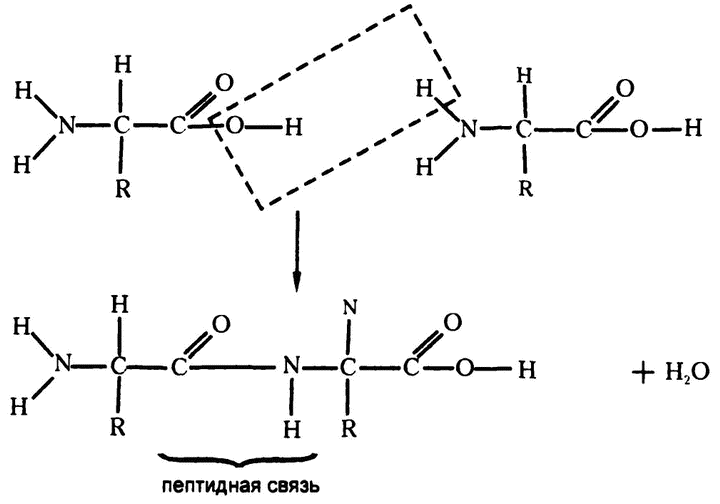
Рис. 29. Соединение аминокислот
Соответственно, достаточно сильными, чтобы вообще оказаться замеченными, силы межмолекулярного притяжения являются только в тех случаях, когда между двумя отрицательно заряженными атомами оказывается атом водорода. Поэтому такая связь получила название «водородная связь» (рис. 28).
Сразу же становится понятно, какое отношение все вышеизложенное имеет к строению белка. Для начала давайте рассмотрим строение аминокислоты в отображении по системе Кекуле:
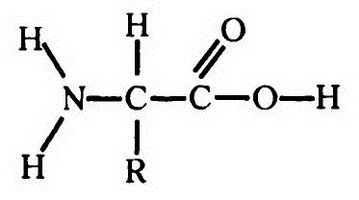
Соединение NH2, изображенное слева, — это аминогруппа; соединение СООН справа — это карбоксильная группа. R, прикрепленное к центральному атому углерода, — это радикал, для каждой конкретной аминокислоты — свой.
Когда соединяются две аминокислоты, то карбоксильная группа одной теряет ОН, а аминогруппа другой — Н. Высвободившиеся части тут же объединяются в молекулу воды. А лишившиеся части атомов аминокислоты тоже объединяются с использованием тех связей, которые освобождаются от ОН и Н соответственно. Этот процесс хорошо показан на рис. 29.
Пептидная связь, соединяющая аминокислоты, имеет, как видите, вот такое строение:
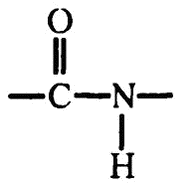
Если представить, что цепочка аминокислот в каком-то трехмерном пространстве наложится сама на себя, то вполне может возникнуть ситуация, когда водород, крепящийся к азоту одной пептидной связи, окажется по соседству с кислородом, крепящимся к углероду другой пептидной связи. А если атом водорода находится между атомами азота и кислорода — то мы имеем идеальные условия для возникновения водородной связи. Один из вариантов такой ситуации изображен на рис. 30, и, как видите, при нем вполне воспроизводится ситуация, продемонстрированная на рис. 25. Водородная связь и есть та «слабая связь», о которой я упоминал.
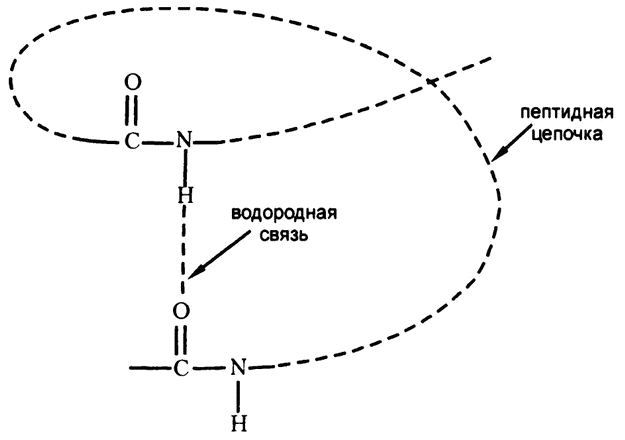
Рис. 30. Водородная связь и пептидная цепочка
В 1936 году американские биохимики Лайнус Полинг и А.Е. Мирски предположили, что именно присутствие в молекуле белка водородных связей делает ее столь хрупкой. Получается, что за особые свойства белка отвечает не только схема аминокислотной цепочки (какие именно аминокислоты и в каком порядке представлены), но и ее трехмерная структура, определяемая водородными связями.
На прочные ковалентные связи, которыми скреплена пептидная цепочка, легкое нагревание действия не окажет, но вот водородные связи, которые в двадцать раз слабее, вполне может разорвать. Из «правильно сложенной» аминокислотная цепочка превращается в таком случае в «свободно болтающуюся», и в результате мы имеем денатурированный белок, утративший свойства белка природного.
Но для того, чтобы понять, как именно должна быть «сложена» аминокислотная цепочка, надо сперва уяснить геометрию молекулы вообще. Насколько удалены друг от друга атомы в молекуле? Какие положения относительно друг друга они занимают? Иными словами — насколько длинными являются межатомные связи и под какими углами друг к другу они расходятся? Можно написать на бумаге двухмерную структурную формулу, но ведь на самом деле структура молекул трехмерна!
Ответ на эти вопросы пришел только с использованием рентгеновских лучей. Если направить пучок рентгеновских лучей на кристалл какого-либо вещества, то упорядоченные слои атомов, составляющие кристалл, частично отразят их. По результатам анализа этого отражения и можно подсчитать расстояние между похожими атомами в структуре кристалла. А там недалеко уже до того, чтобы вывести и саму структуру кристалла.
Этот метод основан на том факте, что облучаемый рентгеновскими лучами объект состоит из упорядочение расположенных атомов. В начале 20-х годов XX века было проведено исследование волокон шелка с помощью рентгеновских лучей. Шелк, разумеется, не кристалл, но и строение его аминокислотных цепочек оказалось в достаточной степени упорядоченным, чтобы произвести соответствующее отражение лучей. Полученные данные позволили показать, к примеру, что длина одной аминокислотной составляющей пептидной цепочки — 0,35 миллимикрона. Отсюда стало возможно высчитать и длину отдельных связей и углы между ними. Затем в 30-х годах XX века с помощью той же технологии были исследованы и другие белки, например содержащийся в волосах кератин.
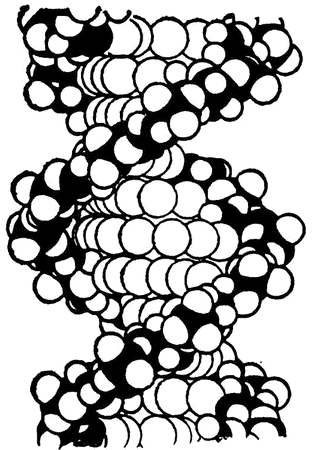
Рис. 31. Спиралевидная молекула
В начале 50-х годов Полинг с коллегами показали на основании полученных данных, что пептидные цепочки могут сворачиваться в спираль (похожую на спираль винтовой лестницы), не теряя при этом ни одной из своих естественных связей. Спиралевидная форма предоставляет прекрасные возможности для образования водородных связей. Более того, несколько таких спиралей могут и сами сворачиваться в спираль (так же, как канат может состоять из нескольких волокон, скрученных таким же образом, как и он сам, из других, более тонких, волокон), и в этом случае опять же вся структура удерживается в нужной форме с помощью водородных связей (рис. 31).
Эта гипотеза нашла экспериментальное подтверждение, и сейчас представление о спиралевидном строении белковых молекул является общепринятым.
| <<< Назад Глава 16. ПОДРОБНЕЕ О БЕЛКАХ |
Вперед >>> Глава 18. КАК РАБОТАЮТ ФЕРМЕНТЫ |
- Глава 13. И СНОВА О ЖИВОЙ И НЕЖИВОЙ МАТЕРИИ
- Глава 14. С МАЛОЙ СКОРОСТЬЮ
- Глава 15. КАТАЛИЗАТОРЫ ЖИЗНИ
- Глава 16. ПОДРОБНЕЕ О БЕЛКАХ
- Глава 17. СЛАБОЕ ПРИТЯЖЕНИЕ
- Глава 18. КАК РАБОТАЮТ ФЕРМЕНТЫ
- Глава 19. ДЛЯ ЧЕГО ЖЕ ОНИ НУЖНЫ?
- Глава 20. ЖИЗНЬ БЕЗ ВОЗДУХА
- Глава 21. ЗНАЧЕНИЕ ФОСФАТОВ
- Глава 22. ПЕРЕДАЧА ЭЛЕКТРОНОВ
- Глава 23. ЖИЗНЬ С ВОЗДУХОМ
- Глава 24. ГДЕ СХОДЯТСЯ ВСЕ ПУТИ
- Глава 25. ОСНОВНОЙ И ГЛАВНЫЙ ИСТОЧНИК
- Великий Аттрактор, или сверхпритяжение
- 25. Причина приливов не притяжение Луны, а давление нагреваемой Солнцем атмосферы
- Притяжение и форма небесных тел
- ТАИНСТВЕННОЕ ПРИТЯЖЕНИЕ
- Притяжение против… притяжения
- 1. Притяжение на расстоянии
- Глава 17. СЛАБОЕ ПРИТЯЖЕНИЕ
- § 19 Закон всемирного тяготения
- Столкновение галактик
- § 11. Взаимодействие частиц
- Глава 3. Разноцветье галактик
- Галактика из стекла
