Книга: Энергия жизни. От искры до фотосинтеза
Глава 16. ПОДРОБНЕЕ О БЕЛКАХ
| <<< Назад Глава 15. КАТАЛИЗАТОРЫ ЖИЗНИ |
Вперед >>> Глава 17. СЛАБОЕ ПРИТЯЖЕНИЕ |
Разделы на этой странице:
- Рис. 23. Диализ с помощью полупроницаемой мембраны
- Рис. 24. Устройство для определения осмотического давления и молекулярных весов белковых молекул
- Таблица 5.ОСНОВНЫЕ СОСТАВЛЯЮЩИЕ БЕЛКОВЫХ МОЛЕКУЛ Название — Год открытия
- аминогруппа — С — карбоксильная группа.
- аминогруппа — С — карбоксильная группа — аминогруппа — С — карбоксильная группа — аминогруппа — С — карбоксильная группа — и так далее.
- Таблица 6.АМИНОКИСЛОТЫ АЛЬБУМИНА Аминокислота … Количество в молекуле белка
Глава 16.
ПОДРОБНЕЕ О БЕЛКАХ
В свете всего описанного в предыдущей главе мы можем еще раз попробовать провести разграничение между живой и неживой природой, между ящерицей и камнем. Давайте попробуем.
Живой организм отличается способностью производить локальное и временное уменьшение энтропии путем химических реакций, катализируемых ферментами.
«Временной» эта способность названа с учетом того, что ящерица не пробудет живой дольше нескольких лет, даже если полностью удовлетворять все ее потребности. Лишь несколько видов животных (человек и некоторые черепахи) живут по сто лет, и лишь некоторые деревья — по тысяче, тогда как неживой предмет, скажем скала, может оставаться неизменным миллиарды лет, а то и бесконечно.
Таким образом, химические реакции, катализируемые ферментами, представляют собой важную часть определения. Именно их наличие отличает живой организм от систем, в которых локальное уменьшение энтропии достигается за счет подключения внешних источников энергии, таких как солнечный свет или внутреннее тепло Земли, и от рукотворных механизмов, в которых локальное уменьшение энтропии достигается за счет тепловых машин, химических батарей и т. п.
В некотором смысле, конечно, наше определение условно. Зачем подчеркивать важность ферментов? Рукотворные компьютеры и технические средства становятся с каждым годом все ближе и ближе к живым существам и даже к самому человеку. Скоро им станут доступны даже такие абстракции, как мышление, суждение, обучение… Можно ли поручиться, что рукотворные предметы никогда не поднимутся на уровень сложности, равный уровню сложности живых существ? А если это произойдет — сможем ли мы отказать им в праве называться «живыми» на том основании, что они не имеют никакого отношения к реакциям ферментации? А если на каком-то этапе разработки искусственных механизмов в них будут включены и ферменты? Достаточно ли этого, чтобы счесть машины живыми?
Или — с другой стороны (не с такой уж и невероятной, как показывают события последних лет): что, если на других планетах обнаружатся объекты, обладающие всеми свойствами, которые принято приписывать живым существам, — возможно, даже разумом? Если химическая природа этих предметов не будет иметь ничего общего с ферментами или даже с белками вообще, если в них не будет происходить совсем никаких химических реакций — сможем ли мы счесть их живыми?
Задумываясь над этими вопросами, остается только пожалеть, что гипотеза о «жизненной силе» оказалась несостоятельной. Вот если бы она была верна, и действительно существовало бы два отдельных свода законов природы — один для живых существ, другой для неживой материи, — то тогда действительно можно было бы составить точное, корректное и безошибочное определение. Живой организм — это тот, который подчиняется таким-то законам, а неживой предмет — таким-то.
Увы, все объекты во Вселенной — и живые, и неживые — существуют по одним и тем же правилам, и поэтому так трудно провести разграничительную линию. Если сделать определение слишком широким — то под него обязательно подпадет какая-нибудь звезда или даже Солнечная система, а чересчур сужая определение, можно сделать его слишком антропоморфным.
Один из вариантов решения этой проблемы — признать саму задачу принципиального различения между живой и неживой материей несущественной. Понятно, что любая попытка провозгласить принцип разделения, прежде всего, окажется попыткой выражения личных пристрастий провозглашающего. Ведь уже само представление о том, что все объекты должны строго делиться на две категории, живых и неживых, — это предрассудок, не имеющий под собой реального обоснования. На самом деле суть в том, что материя может организовываться как простыми, так и сложными способами, и часть сложных способов, которыми самоорганизовывается материя, принято называть «жизнью», а принципиальной границы между этими способами и близкими к ним провести невозможно.
Лично я считаю именно так, но беда в том, что для целей нашей книги эти рассуждения являются «абсолютно верными и абсолютно бесполезными». Условные определения не обязаны представлять собой Истину с большой буквы, главное — чтобы они помогали мыслить и чтобы их условность не отрицалась и не скрывалась. Вот, например, разделение химии на органическую и неорганическую до сих пор соблюдается не потому, что оно истинно, а просто потому, что это удобно.
Таким образом, признавая условность и возможную несостоятельность нашего определения перед лицом будущих успехов человека на ниве роботостроения и космических исследований, я выделил приведенное определение курсивом как пример адекватного ситуации и полезного принципа разделения живых и неживых существ. Оно коротко, просто, ясно и охватывает все примеры, которые вы или я можем встретить в мире на данном этапе развития человечества.
Итак, придя к удовлетворительному, с моей и, надеюсь, с вашей точки зрения, определению разницы между живой и неживой материей, одной из поставленных целей мы добились. Но было бы странно этим и ограничиться, поскольку ряд волнующих вопросов так и остался пока без ответа.
В конце концов, ведь химические реакции и катализаторы встречаются во множестве явно неживых систем. Реакции, происходящие в живых и неживых системах, в основном похожи и подчиняются одним и тем же законам природы. Так почему же разница в катализаторах приводит к таким кардинальным различиям, какие мы видим между живой и неживой природой?
Никто не спорит с тем, что пчела — более тонкий и сложный механизм, чем самолет, а мышь — более удивительная конструкция, чем гора.
Если такую разницу создает одно лишь присутствие фермента, то давайте же присмотримся к нему пристальнее.
Если сравнивать ферменты с обычными катализаторами из неорганических систем, то в глаза бросается множество различий. Ферменты гораздо более хрупки, их легче отключить, они более требовательны к условиям функционирования — им нужны строго определенный уровень температуры и кислотности, присутствие в небольших количествах одних ионов, полное отсутствие других и так далее.
Кроме того, ферменты в высшей степени специализированы. Если неорганические катализаторы, подобные платине или кислотам, способны ускорять множество реакций, то ферменты могут катализировать их лишь строго ограниченное количество. Очень часто один фермент проявляет способность катализировать лишь одну-единственную реакцию, никак не влияя на ход других, как бы они ни были на нее похожи.
Причиной этих различий (скорее количественных, чем качественных, но тем не менее бросающихся в глаза) является различие в строении неорганических катализаторов и ферментов. Ферменты — это белки, а другие катализаторы — нет. И естественно предположить, что необычные свойства ферментов — следствие их белковой природы.
С этого и начнем.
На протяжении XIX века про молекулы белков точно знали только одно — что они большие.
Так, в 1860 году шотландский химик Томас Грэм обнаружил, что если с помощью листа пергамента разделить раствор некоего вещества в воде на участки с собственно раствором и чистой водой, то частицы растворенного вещества часто все же могут проникнуть через бумажную мембрану в «очищенную» часть. Химические тесты того времени позволяли легко обнаружить их.
Но оказалось, что таким свойством обладают далеко не все растворимые вещества. Поваренная соль и другие неорганические вещества проходят сквозь пергамент без проблем. Такие органические вещества, как сахара, — тоже. А вот растворенный белок так и остается по «свою» сторону пергамента. Грэм разделил все вещества на две категории — те, растворы которых проходят сквозь пергамент, и те, растворы которых не проходят. Поскольку проходящие сквозь пергамент вещества при испарении раствора легко проявляются в виде кристаллов, то он назвал их кристаллоидами, а клееобразные белковые растворы — «коллоидами», от греческого слова «колла» — «клей».
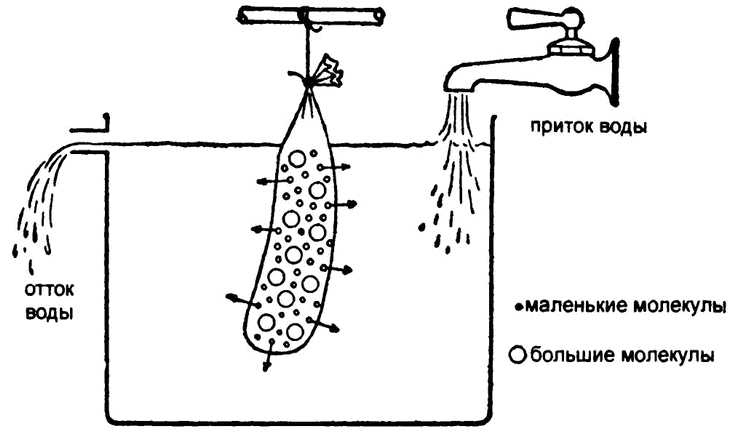
Рис. 23. Диализ с помощью полупроницаемой мембраны
Самое простое (и, за некоторыми уточнениями, верное) объяснение этому явлению кроется в том, что в пергаменте есть микроскопические поры, сквозь которые маленькие молекулы пролезают, а большие — нет. В результате пергамент и подобные ему мембраны — в первую очередь мембраны, окружающие живые клетки, — стали называть полупроницаемыми.
Так появился один из самых распространенных ныне способов очистки белковых растворов. Раствор белка помещали в мешок из полупроницаемой мембраны (в те времена самым распространенным материалом такого рода оказывалась колбасная оболочка — кишка) и подвешивали в проточной воде. Все вещества с малым молекулярным весом просачивались сквозь мембрану и смывались, а большие белковые молекулы оставались в мешке. Этот процесс носит название «диализ», или «мембранная сепарация» (рис. 23).
Тот факт, что белки не проходят сквозь полупроницаемую мембрану, устанавливает нижнюю планку размера белковой молекулы; тот факт, что белки все же растворяются, — верхнюю. Последний момент надо объяснить подробнее.
На каждую растворенную в воде частицу действуют две противоположно направленные силы. Первая — это сила тяжести, тянущая частицы вниз (предположим, что их плотность больше плотности воды; как правило, это так и есть), а вторая — это бомбардировка молекулами воды, постоянные случайные удары, поддерживающие вещество в равномерно растворенном состоянии. (Если частицы несут электрический заряд, то есть еще притягивающие и отталкивающие электрические силы, но этого момента мы сейчас касаться не будем.)
Для частиц любого видимого размера самой важной является сила тяжести, поэтому в конечном итоге они тонут. Однако чем меньше частица, тем большее значение приобретает бомбардировка молекулами и тем меньше становится скорость осаждения вещества. Описанное мной распределение явно видно, если горсть земли бросить в миску с водой. Любые камушки, если таковые там окажутся, тут же опустятся на дно. Чуть позже осядут и частицы чуть покрупнее, потом — помельче, наконец, — самые крохотные. В итоге в воде останется взвесь, поскольку какие-то частицы так и не опустятся на дно, потому что они настолько малы, что молекулярная бомбардировка нивелирует действие силы тяжести, сводя скорость их осаждения до крайне малых значений, а то и до нуля.
На самом деле частицы, чей размер достаточно мал, чтобы они оставались во взвешенном состоянии вечно, глазом неразличимы. Однако для того, чтобы рассеивать свет, их размера вполне достаточно — это явление обнаружил в 70-х годах XIX века британский физик Джон Тиндаль, и в его честь оно называется «эффект Тиндаля». Если пропустить через такой раствор луч света и посмотреть на емкость с раствором под прямым углом к лучу, то луч будет выглядеть как светлый туннель, проходящий сквозь туман. Именно благодаря взвеси мельчайших частиц, рассеивающих свет в направлении глаза наблюдателя, и виден луч.
Если же вместо человеческого глаза за происходящим наблюдает специальный микроскоп («ультрамикроскоп»), то через него видны и сами частицы в виде ярких точек.
Чем меньше частицы, тем слабее эффект рассеивания света, и когда их размер уменьшается настолько, что они уже могут проходить сквозь полупроницаемую мембрану, то эффект становится незаметным, и физики говорят, что раствор «оптически чист».
В растворах белков эффект Тиндаля наблюдается. С учетом того, что белковые молекулы достаточно велики, чтобы полупроницаемые мембраны оказывались для них непреодолимыми, и при этом достаточно малы, чтобы пребывать во взвешенном состоянии, в целом можно сказать, что они «коллоидных размеров».
«Коллоидные размеры» включают от 1 до 1000 миллимикронов в диаметре (напомню, миллимикрон — это одна миллиардная метра). Даже самые маленькие из коллоидных частиц должны состоять, соответственно, из тысяч атомов, а самые крупные — из триллионов. А средний вес одного атома молекулы белка — 7. Соответственно, можно сказать, что молекулярный вес белков, раз они лежат на отрезке «коллоидных размеров», — от 7000 до 7 000 000 000 000.
Столь большой разброс никак не может нас устроить в качестве «точных данных», но даже его достаточно, чтобы понять, что молекулы белка гораздо крупнее, чем молекулы таких веществ, как поваренная соль (молекулярный вес 58,5) или глюкоза (180).
В последней четверти XIX века ученые взялись за проблему установления точных значений молекулярных весов огромных молекул вроде белков. Один из способов добиться этого — диализ. Если с одной стороны полупроницаемой мембраны находится белковый раствор, а с другой — чистая вода, то молекулы воды могут свободно перемещаться сквозь мембрану в обоих направлениях. Однако со стороны раствора крупные молекулы белков «забивают» микропоры, через которые могла бы пройти вода.
В результате молекулы воды из половины с чистой водой в половину с раствором белка переходят активнее, чем наоборот, и получается течение из одной половины в другую, отчего и образуется разность уровней воды между двумя половинами. Из-за этой разности уровней давление в половинке с раствором становится выше, и его компенсирующее действие прекращает перетекание воды.
Такое неравномерное перетекание воды получило название «осмос» (от греческого слова, означающего «толкать»), а создаваемое им давление — «осмотическое» (рис. 24). Величина осмотического давления зависит от количества крупных молекул, блокирующих поры, — чем их больше, тем выше давление.
Теперь предположим, что у нас имеется некое количество белка, точный вес которого известен. Чем крупнее его молекулы, тем меньше их будет в образце вещества одного и того же веса. То есть для образца белка, вес которого известен, чем ниже осмотическое давление, тем больше молекулярный вес.
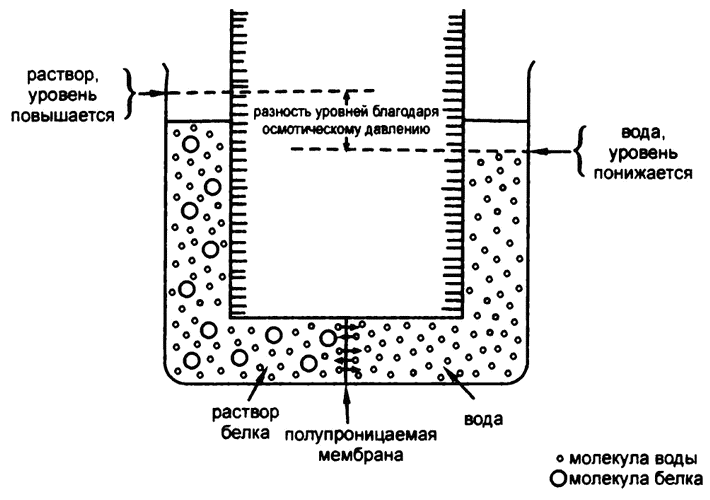
Рис. 24. Устройство для определения осмотического давления и молекулярных весов белковых молекул
Первым измерить осмотическое давление в различных коллоидных растворах попытался в 1877 году немецкий ботаник Вильгельм Пфеффер. К 1885 году голландский специалист в области физической химии Якоб Хендрик Вант-Гофф вывел точную формулу зависимости осмотического давления от молекулярного веса вещества, и началась полномасштабная доработка методики.
К 1917 году методы определения молекулярного веса через измерение осмотического давления стали уже вполне надежными. В этот год датский химик Серен Петер Лауриц Сёренсен объявил, что молекулярный вес яичного белка (того самого первого белка, который дал название всем остальным!) — 34 000. Вскоре после этого было установлено, что молекулярный вес гемоглобина (главного белка красных кровяных телец) — 67 000.
К сожалению, когда молекулярный вес вещества доходит до сотен тысяч, осмотическое давление падает до столь малых значений, что получение каких-либо точных данных становится делом уже невозможным. Поэтому установить молекулярный вес многих важных белков так и не смогли. Однако уже к 1925 году стало ясно, что молекулярный вес белков редко опускается ниже 10 000, а у многих важных белков — превышает 100 000.
Одновременно с исследованиями проникновения через мембрану шло и параллельное наступление на тайны белков — со стороны изучения их осаждения. Как я уже говорил, чем мельче частицы, тем медленнее они осаждаются. К сожалению, все белковые молекулы достаточно малы, чтобы скорость их осаждения равнялась нулю, так что большие белковые молекулы от маленьких белковых молекул таким образом отличить невозможно — по крайней мере, при обычных условиях.
Чтобы сделать возможным практическое использование скорости осаждения, надо сделать что-то равносильное усилению силы тяготения (до такого уровня, при котором белковые молекулы все же начинают осаждаться, каждая со своей скоростью, определяемой ее размером). Изменить силу тяготения как таковую человек пока еще не в силах, но того же результата можно добиться и с помощью другого явления. Если сосуд с жидкостью быстро вращать, то его содержимое будет сдвигаться от центра вращения в сторону стенок. Во многих отношениях этот центробежный эффект сродни силе тяготения, и, как и сила тяготения, он тоже приводит к осаждению взвесей. Но для центробежной силы, в отличие от силы тяготения, ничего не стоит установить желаемую величину.
В 1925 году шведский химик Теодор Сведберг разработал «ультрацентрифугу», которая могла производить столь быстрое вращение, что белковые молекулы под его действием принимались осаждаться из раствора (сейчас возможно создание центрифуг, имитирующих силу тяжести в 500 000 раз больше действительной).
С помощью оптических устройств можно отследить изменения скорости осаждения по мере разгона центрифуги. Если в растворе присутствует более одного белка, то можно отслеживать скорость осаждения каждого из них в отдельности. (Скорость осаждения зависит не только от веса, но и от формы молекулы, вытянутая молекула будет осаждаться быстрее, чем круглая, при одинаковом весе, так что для того, чтобы по скорости осаждения можно было адекватно судить о молекулярном весе вещества, надо сначала отдельно установить форму молекулы.)
С началом использования ультрацентрифуги количество белков с известным молекулярным весом пошло в гору. Выяснилось, что молекулярный вес белка фибриногена (присутствующего в крови и обеспечивающего свойство сворачиваемости) — 330 000, гемоцианина (синеватого белка, присутствующего в крови морских животных) — 4 000 000, а белков, из которых состоят вирусы, — более 10 000 000.
Однако сейчас нас интересуют ферменты, а это — не самые крупные из белковых молекул. Молекулярный вес подавляющего большинства ферментов — от 10 000 до 500 000, и очень немногие ферменты лежат вне этих рамок.
Но сам по себе большой размер молекулы фермента по сравнению с молекулами других катализаторов еще не может служить объяснением его необычных свойств. Многие органические молекулы других типов тоже имеют огромные размеры — крахмал, целлюлоза, резина, множество синтетических пластмасс, — но свойствами ферментов они при этом не обладают.
Одно из основных различий между белками (в том числе ферментами) и другими огромными молекулами заключается в том, как легко белки разрушаются. Можно, конечно, сказать, что чем крупнее молекула, тем сложнее удержать ее в целостности в условиях вибраций или высоких температур. Но почему на белки это правило распространяется, а на другие огромные молекулы — нет? Сам по себе размер не означает хрупкости. Древесина состоит из огромных молекул, но она достаточно прочна, чтобы служить строительным материалом и выдерживать сильнейшие вибрации без каких-либо видимых последствий.
Так что дело явно в чем-то другом.
Две структуры одинакового размера могут иметь разную стабильность, в зависимости от природы своих составляющих. Трехметровой высоты дом из деревянных блоков — это просто воплощение стабильности, особенно по сравнению с такой же высоты строением из игральных карт. Можем ли мы сравнить составляющие белков с глюкозой, из которой состоят крахмал и целлюлоза, и выяснить, в чем же между ними разница?
Установить составляющие единицы белка оказалось сложнее, чем других огромных молекул, хотя французский химик А. Браконно взялся за это довольно рано. Успешно разложив с помощью методов Кирхгофа (нагреванием с использованием кислоты) ряд углеводов, в 1820 году он обратил внимание на белок желатин.
Это вещество тоже оказалось очень просто разложить с помощью кислоты, и в результате были получены сладковатые кристаллы, которые ученый, разумеется, счел разновидностью сахара. Браконно назвал полученное вещество «желатиновым сахаром». Однако вскоре выяснилось, что из этих кристаллов можно выделить аммиак (NH3), а значит, обычным сахаром они быть не могут, если в них содержатся атомы азота. В итоге вещество получило название «глицин», от греческого слова, означающего «сладкий», с добавлением суффикса «-ин», типичного для азотсодержащих веществ.
Однако это открытие не решило задачу установления структурной единицы белка. Да, другие огромные молекулы состоят из одного и того же структурного элемента, который достаточно определить один раз, но белки — другое дело. Были обнаружены и другие блоки, похожие на глицин. Один из них открыл сам Браконно, назвав его «лейцин», и список этих веществ пополнялся на протяжении всего XIX века и части XX века.
Точное число их назвать нелегко, поскольку некоторые встречаются лишь в нескольких белках, и непонятно, включать ли их в общий список. Общепринято говорить о девятнадцати веществах, присутствующих в числе продуктов распада практически всех крупных белков. Их названия приведены, в порядке открытия, в таблице 5.
Конечно, на самом деле этот список не так уж разнороден, как может показаться. У всех этих веществ много общего. В частности, каждое имеет в своем составе соединение, именуемое «карбоксильной группой» и обладающее кислотными свойствами, и комбинацию атомов под названием «аминогруппа». Последний факт подтолкнул Берцелиуса еще в 1848 году назвать все эти вещества «аминокислотами», — и это название было принято. Соответственно, все белки состоят из аминокислот.
Таблица 5.
ОСНОВНЫЕ СОСТАВЛЯЮЩИЕ БЕЛКОВЫХ МОЛЕКУЛ
Название — Год открытия
Глицин — 1820
Лейцин — 1820
Тирозин — 1849
Серии — 1865
Глютаминовая кислота — 1866
Аспарагиновая —
кислота — 1868
Фенилаланин — 1881
Алании — 1888
Лизин — 1889
Аргинин — 1895
Гистидин — 1896
Цистин — 1899
Цистеин — 1901
Валин — 1901
Пролин — 1901
Триптофан — 1901
Изолейцин — 1903
Метионин — 1922
Треонин — 1935
Во всех случаях карбоксильную группу отделяет от аминогруппы лишь один атом углерода, то есть все молекулы аминокислот, составляющих белки, имеют вот такой «скелет»:
аминогруппа — С — карбоксильная группа.
В состав самой простой (и самой первой из обнаруженных) аминокислоты — глицина — входят два атома водорода, каждый из которых прикреплен напрямую к тому самому центральному атому углерода, и больше в молекуле глицина нет ничего. Во всех прочих аминокислотах к центральному атому углерода тоже прикреплен, помимо карбоксильной и аминогруппы, один атом водорода, а вот вместо второго имеется более-менее сложная углесодержащая группа атомов, именуемая «радикалом». Так что полную схему углекислоты можно записать так:

Как видно, все аминокислоты структурно похожи друг на друга и различаются только тем, что у них разные радикалы.
К концу века, когда из белков уже было выделено с десяток аминокислот, стало понятно, что пора приступить и, наоборот, к синтезу белка из аминокислот. Этой проблеме посвятил свою работу немецкий химик Эмиль Фишер. Он терпеливо создавал аминокислотам одно за другим все условия, которые могли стимулировать соединение органических веществ.
В 1907 году ему удалось собрать молекулу, состоящую из восемнадцати аминокислот — пятнадцати глицинов и трех лейцинов. Сейчас такие короткие цепочки аминокислот называют пептидами, от греческого слова, означающего «пищеварение», потому что они являются продуктами первого шага расщепления белков при пищеварении.
Достижение Фишера навсегда положило конец любым спорам о том, являются ли аминокислоты строительными кирпичиками для белков. Полученное им вещество, состоящее из восемнадцати аминокислот, проявляло все свойства, которые только можно было ожидать от простейшего белка. Ученый продемонстрировал, что при формировании цепочки карбоксильная группа одной аминокислоты соединяется с аминогруппой другой, так что скелет пеп тидов выглядит примерно так:
аминогруппа — С — карбоксильная группа — аминогруппа — С — карбоксильная группа — аминогруппа — С — карбоксильная группа — и так далее.
Центральный атом углерода каждой из участвующих в цепочке аминокислот имеет собственный радикал (в случае с глицином в роли радикала выступает единственный атом водорода), так что пептид можно рассматривать как однородную цепочку, из которой торчат различные радикалы, тип и порядок расположения которых отражает расположение в цепочке различных аминокислот.
Связь между карбоксильной группой и аминогруппой, впервые продемонстрированная Фишером, называется «пептидной», и накопленные с тех пор данные позволяют с наибольшей уверенностью, какую только может позволить себе наука вообще, говорить о том, что все существующие в природе белки состоят из аминокислот, скрепленных между собой пептидными связями.
С тех пор разработано уже много новых методов синтеза пептидных цепочек. С помощью метода, изобретенного в 1947 году израильским ученым Е. Качальским, при котором изначально используются несколько видоизмененные молекулы аминокислоты, можно создавать пептидные цепочки длиной до 200 аминокислот.
Как видите, природа строительных элементов для белков уже сама по себе заставляет видеть в белках нечто принципиально отличное от любых других огромных молекул. Молекулы крахмала и целлюлозы состоят из одинаковых единиц — из глюкозы. Огромная молекула инулина (крахмалоподобного соединения, производимого иерусалимским артишоком) состоит исключительно из фруктозы. Резина — только из углевода под названием «изопрен». Гиалуроновая кислота — скользкое вещество, служащее для уменьшения трения в суставах живого организма и встречающееся в межклеточном пространстве, — состоит из двух равномерно чередующихся разновидностей сахара. Все синтетические пластмассы состоят либо из одинаковых единиц, либо из двух видов единиц, чередующихся в составе вещества равномерно.
Соответственно, молекулы крахмала могут различаться между собой только количеством составляющих их единиц глюкозы; молекулы инулина — количеством единиц фруктозы и так далее. Разумеется, и этого достаточно, чтобы разница между представителями одного и того же вида огромных молекул была гораздо больше, чем между представителями одного вида меньших молекул, но все равно это ничто по сравнению с разнообразием, которое представляют белки.
Молекулы белка состоят из девятнадцати разных аминокислот (плюсминус одна), которые в той или иной молекуле могут быть представлены в любом количестве каждая, и порядок их размещения в пептидной цепочке тоже может быть любым. И любое изменение в размещении аминокислот приводит к появлению молекулы уже с другими свойствами. Белковые молекулы могут различаться между собой не только тем, что в состав одной входит восемнадцать аминокислот, а другой — девятнадцать. Две молекулы, состоящие обе из восемнадцати или девятнадцати аминокислот, могут разительно отличаться порядком расположения аминокислот, а значит, и своими свойствами.
Сколько же возможно в принципе таких вариаций? Допустим, строится молекула, в которой должно присутствовать по одной из каждых девятнадцати видов аминокислот. Начать можно с любой из девятнадцати, это дает нам уже девятнадцать вариантов. Далее продолжить каждый из них можно с помощью каждой из восемнадцати оставшихся аминокислот, так что мы имеем уже 19 х 18 сочетаний, каждое из которых можно продолжить с помощью каждой из 17 оставшихся, и так далее.
Продолжая рассуждать таким образом, мы получаем общее число возможных вариантов 19 x 18 x 17 x 16 x 15 x 14 x 13 x 12 x 11 x 10 x 9 x 8 x 7 x 6 x 5 x 4 x 3 x 2 x 1— такую последовательность называют «19 факториал» и записывают как 19! (цифра, а рядом с ней — восклицательный знак). Факториалы очень быстро достигают невообразимых значений — в данном случае вы и сами можете просчитать величину 19!, а если не хотите — то поверьте мне на слово, что получится число больше сотни квадриллионов (точнее, 121 646 600 408 832 000).
Соответственно, даже если ограничить возможность повторения одной и той же аминокислоты в цепочке одним разом, то из девятнадцати аминокислот можно построить более ста квадриллионов различных веществ с различными же свойствами.
На самом же деле белки состоят из гораздо большего количества повторяемых аминокислот. Гемоглобин, молекулярная масса которого 67 000, состоит из 539 аминокислот. Разумеется, они не могут быть все разными, что в значительной степени снижает количество возможных вариантов, но даже в этом случае получится величина порядка 4 x 10619, то есть четверки с 619 нулями.
Представить себе такое число невозможно. Достаточно просто уяснить себе, что количество различных белков, которые можно построить из девятнадцати аминокислот, как и количество различных книг, которые можно написать с помощью двадцати шести букв латинского алфавита, — для всех практических соображений следует счесть бесконечным.
С точки зрения энергетических соображений значение столь большого числа, с одной стороны, совершенно ясно, а с другой — очень интересно. Сравнительно несложно просто собрать вместе некоторое количество аминокислот, как это сделали Фишер или Качальский. Это равносильно тому, что собрать несколько игральных карт и просто сложить их в стопку не глядя.
Конечно, в стопке карт порядка больше, чем в картах, рассыпанных по полу, то есть и при такой сборке энтропия уменьшается (вспомните отношения между энтропией и порядком, описанные в главе 6). Соответственно, создание пептида из аминокислот — это процесс, связанный с уменьшением энтропии.
Однако образование некоего определенного белка, например гемоглобина, из практически неисчерпаемого набора аминокислот, можно сравнить с упорядочиванием карт в колоде по некоему строго определенному образцу. При этом порядок возрастает (а энтропия, следовательно, уменьшается) многократно. Работа, совершаемая организмом при формировании белка, достойна восхищения, потому что он не просто объединяет аминокислоты в пептидную цепь, но соединяет их в строго заданную пептидную цепь!
Именно поэтому невозможно вывести формулу какого-либо белка путем простого подсчета атомов. Если провести такую попытку, то в результате мы получим что-то вроде C1864H3012O576N468S21. Это, конечно, настоящая формула, и ей соответствует, к примеру, присутствующий в молоке белок беталактоглобулин. Но понять из такого «индекса атомов», из каких аминокислот состоит белок, невозможно, а значит, и пользы в нем практически нет никакой. Молекулу белка надо рассматривать с точки зрения аминокислотного, а не атомного состава.
Простой способ анализа аминокислотного состава белка заключается в том, чтобы путем нагревания в кислоте разложить белок на аминокислоты и проанализировать полученную смесь на наличие каждой из аминокислот по отдельности. К сожалению, смесь получается слишком сложной, а свойства некоторых аминокислот слишком похожи, так что полноценно разделить смесь на отдельные аминокислоты не представляется возможным. До 1940 года анализу аминокислотного состава белков не хватало точности и полноты.
Однако в 1944 году двое английских биохимиков, А. Мартин и Р. Синг, изобрели бумажную хроматографию. Метод заключается в том, чтобы капнуть немного смеси аминокислот на лист очень пористой (фильтровальной) бумаги и дать листу высохнуть, после чего аминокислоты оказываются прочно скованными в листе. Тогда по капиллярам в бумаге начинают вытягивать органическую жидкость, например бутиловый спирт (близкий к известному нам этиловому спирту).
Когда бутиловый спирт проходит через пятно аминокислот, то каждая из них оказывается под действием двух сил: одна — удерживает присохшие кислоты на месте, другая — тянет их двигаться дальше вместе со спиртом. В итоге каждая кислота действует неким компромиссным образом (поскольку каждая из них, благодаря разнице в химическом составе, имеет свой показатель растворимости в воде и в бутиловом спирте). То есть скорость движения аминокислот по листу вместе со спиртом — своя для каждой аминокислоты, и через некоторое время все аминокислоты оказываются «разнесенными» по листу. Вот теперь можно разделить и подвергнуть тщательному анализу составляющие даже очень сложной смеси аминокислот.
С помощью метода бумажной хроматографии большинство белков были проанализированы на аминокислотный состав. К примеру, в таблице 6 приводится количество каждой из девятнадцати аминокислот, обнаруженных в альбумине — белке, встречающемся в плазме крови человека.
Таблица 6.
АМИНОКИСЛОТЫ АЛЬБУМИНА
Аминокислота … Количество в молекуле белка
Глютаминовая кислота … 80
Лейцин … 58
Лизин … 58
Аспарагиновая кислота … 46
Валин … 45
Фенилаланин … 33
Пролин … 31
Треонин … 27
Аргинин … 25
Серии … 22
Тирозин … 18
Цистин … 16
Гистидин … 16
Глицин … 15
Изолейцин … 9
Метионин … 6
Цистеин … 4
Триптофан … 1
Алании … 0
Всего … 510
Разумеется, просто знать количество каждой из аминокислот в молекуле белка недостаточно. Надо было еще установить, в каком порядке они располагаются.
Эта задача казалась вообще неразрешимой. Количество возможных перестановок даже в самых маленьких белковых молекулах так велико, что попытки угадать фактическое их расположение сродни поиску иголки не то что в стоге сена, а в целом поле стогов сена.
Однако в конечном итоге человеческому гению эту задачу удалось решить. Это сделал английский биохимик Фредерик Сенгер со своими коллегами. Сенгер работал с инсулином, молекула которого сравнительно мала — этот белок состоит всего из 50 аминокислот, и его молекулярный вес — всего 6000. (Впрочем, даже и в этом случае количество возможных комбинаций аминокислот, присутствующих в известном соотношении, тоже значительно превышает 10100 — то есть единицу со 100 нулями.)
Методика Сенгера в упрощенном виде выглядит так: молекулу белка расщепляют не полностью, а частично, так чтобы на выходе получались не отдельные аминокислоты, а пептидные цепочки из двух, трех или четырех аминокислот. Порядок аминокислот в этих цепочках уже можно установить, а от них — перейти к порядку аминокислот в более крупных фрагментах, и в итоге — получить порядок аминокислот в самой изначальной цепочке.
Конечно, все это сделать не так просто. В реальности работа оказалась кропотливой, долгой и крайне сложной. Тем не менее к 1953 году (не прошло и десяти лет с момента начала работы) строение инсулина уже было точно установлено. В частности, ученым удалось четко выяснить, чем именно свиной инсулин отличается от бычьего — какая именно аминокислота заменяется на другую.
Затем по этой же методике было установлено строение и других, более сложных белковых молекул. К 1959 году была столь же точно выявлена и структура фермента «рибонуклеаза», в состав которого входит уже 121 аминокислота.
После того как порядок аминокислот в белках был установлен, можно было вплотную приступать к решению загадки столь масштабного уменьшения энтропии, какое имеет место в организме при синтезе строго определенной белковой молекулы. Эта задача оказалась совсем непростой. Процесс построения белка выполняется в несколько шагов, на каждом из которых к строящейся цепочке должна добавляться строго определенная аминокислота, и только она одна. Естественно, в качестве первых целей выбирались самые простые белки. Так, первой искусственно синтезированной молекулой стал окситоцин — гормон гипофиза. Автором этого открытия стали американский биохимик Винсент дю Виньо и его коллеги в 1953 году. Молекула окситоцина миниатюрна по белковым меркам — она состоит всего из восьми аминокислот, так что и белком-то его в принципе можно назвать с натяжкой, однако сам факт был принят научным сообществом с восторгом. Главное — что синтезированный продукт проявил все свойства натурального, и, таким образом, с помощью синтеза на практике было доказано, что молекулярное строение гормона установлено верно.
В 1960 году другой американский биохимик, Клаус Хофман, продвинулся еще дальше, синтезировав цепочку из 23 аминокислот — часть молекулы еще одного продукта гипофиза, адренокортикотрофного гормона.
Вообще, химики с каждым годом добиваются все большего успеха в изучении строения белковых молекул, а если учесть, что реальная работа в этом направлении началась относительно недавно, то в ближайшем будущем можно ожидать в этой области больших достижений.
Но во всем, о чем я до сих пор рассказывал, причина хрупкости белковой молекулы до сих пор не затрагивалась.
| <<< Назад Глава 15. КАТАЛИЗАТОРЫ ЖИЗНИ |
Вперед >>> Глава 17. СЛАБОЕ ПРИТЯЖЕНИЕ |
- Глава 13. И СНОВА О ЖИВОЙ И НЕЖИВОЙ МАТЕРИИ
- Глава 14. С МАЛОЙ СКОРОСТЬЮ
- Глава 15. КАТАЛИЗАТОРЫ ЖИЗНИ
- Глава 16. ПОДРОБНЕЕ О БЕЛКАХ
- Глава 17. СЛАБОЕ ПРИТЯЖЕНИЕ
- Глава 18. КАК РАБОТАЮТ ФЕРМЕНТЫ
- Глава 19. ДЛЯ ЧЕГО ЖЕ ОНИ НУЖНЫ?
- Глава 20. ЖИЗНЬ БЕЗ ВОЗДУХА
- Глава 21. ЗНАЧЕНИЕ ФОСФАТОВ
- Глава 22. ПЕРЕДАЧА ЭЛЕКТРОНОВ
- Глава 23. ЖИЗНЬ С ВОЗДУХОМ
- Глава 24. ГДЕ СХОДЯТСЯ ВСЕ ПУТИ
- Глава 25. ОСНОВНОЙ И ГЛАВНЫЙ ИСТОЧНИК
- От редактора
- Как сделать выбор между «цинковым» и «железосерным» мирами?
- Датирование по животным
- «Противозаконные» хвосты
- Часть 2: Векторные данные
- Часть 8: Подготовка карт
- «Цинковый мир»
- Глава 16. ПОДРОБНЕЕ О БЕЛКАХ
- 7. Подробнее о межвидовой территориальности
- Межклеточное вещество
- Список литературы
- Красные тучи, закрывающие солнце
