Книга: Энергия жизни. От искры до фотосинтеза
Глава 22. ПЕРЕДАЧА ЭЛЕКТРОНОВ
| <<< Назад Глава 21. ЗНАЧЕНИЕ ФОСФАТОВ |
Вперед >>> Глава 23. ЖИЗНЬ С ВОЗДУХОМ |
Разделы на этой странице:
- 2Fe2O3 + ЗС ? 3CO2 + 4Fe.
- Рис. 53. Окислительно-восстановительная реакция
- Рис. 54. Дегидрогенизация — электронная запись
- Рис. 55. Образование двойных связей
- Рис. 56. Свободный радикал трифенилметил и его отношение к бензольному кольцу
- 2H2O2 ? 2H2O + O2.
- Рис. 57. Перекись водорода и вода
- АН2 ? А + 2Н.ВН2 ? В + 2Н и так далее.
- АН2 + В ? ВН2 + А.
Глава 22.
ПЕРЕДАЧА ЭЛЕКТРОНОВ
Львиная доля производимой в процессе обмена веществ энергии выделяется в ходе реакций, в которых участвует атмосферный кислород. Перед тем как мы сможем свободно рассуждать об этих реакциях, надо сначала обговорить основные вещи.
Общепринятый термин для описания всех реакций, при которых в наличии имеется пламя, — «горение». Однако, после того, как Лавуазье показал, что при сгорании древесины происходит массированное соединение содержащихся в ней веществ с кислородом, распространение получило и более осмысленный термин «окисление».
Этот термин оказался не только более осмысленным, но и более общим. Процесс медленного соединения металлов с кислородом, в результате которого образуется окалина (сейчас мы называем ее оксидом), как показал Лавуазье, тоже является окислением, хотя горением его не назовешь. Иными словами, окисление — это любая реакция соединения вещества с атмосферным кислородом, независимо от того, вспыхивает ли при этой реакции пламя. Атмосферный кислород является в данном случае примером «агента окисления» (это может показаться тавтологией, но вскоре я покажу, что атмосферный кислород — не единственный распространенный в природе агент окисления).
С другой стороны, долгое время было принято говорить о процессе «восстановления» (англ. «reduction», от латинского «вести обратно») руды в состояние металла. Люди много веков наблюдали, как железо превращается в ржавчину, а большая часть металлических руд тоже похожа на ржавчину.
Обращаться с оксидами металлов, как с рудой, приходится довольно часто. Чтобы снова сделать из них металл, требуется удалить из состава оксидов атом кислорода. Так, если нагревать железную руду вместе с коксом, то атомы углерода, содержащиеся в коксе, соединятся с атомами кислорода, содержащимися в руде, оставляя металл свободным:
2Fe2O3 + ЗС ? 3CO2 + 4Fe.
Поскольку восстановление спровоцировал углерод, то он являет собой пример «агента восстановления».
Таким образом, окисление — это процесс добавления кислорода к веществу, а восстановление — процесс удаления кислорода из вещества. Природа этих двух процессов прямо противоположна.
Есть еще один распространенный способ устранения кислорода из соединения с металлом — обработка водородом. В этом случае водород, как и углерод, служит агентом восстановления. Он вступает в соединение с кислородом и восстанавливает, в частности, медь, после того как она окислится дочерна.
Реакции с использованием водорода вызывают особый интерес у органических химиков. Они обнаружили, что определенные химические вещества, богатые кислородом и способные окислять металлы путем формирования оксидов, имеют также и свойство «выдирать» водород из молекул органических соединений. Соответственно, эти богатые кислородом вещества, среди которых — перманганат калия (КMnO4) и хромовокислый калий (К2CrO4), тоже являются агентами окисления. У ученых создалось стойкое представление, что все они отдают часть своего кислорода на окисление металлов или используют его для соединения с водородом, выцепляя его из органических молекул с последующим образованием воды. Соответственно, потеря водорода (дегидрогенизация) тоже стала рассматриваться учеными как форма окисления, даже если ни один атом кислорода к органической молекуле напрямую и не присоединялся.
Однако, если окисленную таким образом органическую молекулу обработать газообразным водородом (как правило, в присутствии какого-нибудь катализатора), реакцию окисления можно обратить вспять. Добавление водорода (гидрогенизацию) можно, таким образом, рассматривать как реакцию восстановительную, даже если опять же никакой кислород ниоткуда не извлекался.
Короче говоря, органические химики решили рассматривать окисление как добавление кислорода или удаление водорода, а восстановление — как удаление кислорода или добавление водорода.
Но и это еще не все обобщение. Металлы покрываются ржавчиной и патиной и под воздействием фтора, хлора, брома и серы, хотя ни кислород, ни водород тут вообще ни при чем. Точно таким же образом в качестве восстановительных агентов могут выступать металлический натрий, калий, магний и кальций, хотя в происходящих с их участием реакциях не затрагивается ни кислород, ни водород. Распространять термины «окисление» и «восстановление» на бесконечное множество реакций добавления и извлечения того или иного вещества казалось уже неразумным, и надо было ввести какое-то более глобальное обобщение. Оно было сделано только после открытия электронов.
В XX веке обнаружилось, что, подвергаясь окислению, вещество теряет электроны, а подвергаясь восстановлению — получает. Возникло естественное предложение вообще перестать использовать термины «окисление» и «восстановление» в связи с приобретением или потерей веществом какого-либо элемента, а пользоваться ими для обозначения процессов потери или приобретения электронов.
К примеру, когда металлический натрий вступает в реакцию с газообразным хлором для образования хлорида натрия, атом натрия теряет электрон и становится ионом натрия. Соответственно, можно сказать, что хлор окислил натрий, и рассматривать хлор как агент окисления. Однако в ходе той же самой реакции атом хлора приобретает электрон и становится ионом хлора. Значит, натрий восстанавливает хлор и является в таком случае агентом восстановления (рис. 53).
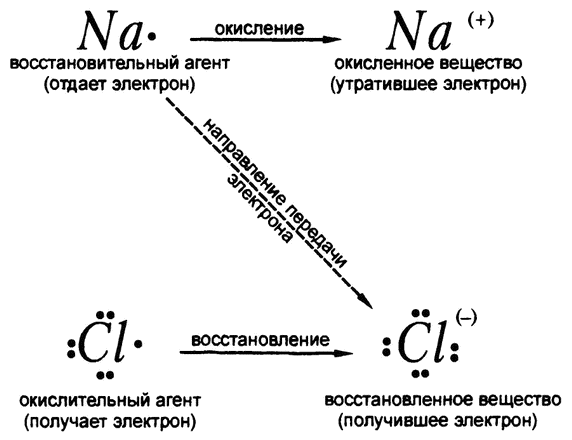
Рис. 53. Окислительно-восстановительная реакция
Опять же, при горении углерода в кислороде образуется углекислый газ, в котором каждый атом углерода связан ковалентными связями с двумя атомами кислорода. Передачи электрона, как таковой, в данном случае не происходит, ни один атом не теряет полностью электрона и не приобретает его. Но атом кислорода держит электроны крепче, чем атом углерода. Так что можно сказать, что атом углерода теряет часть своего электрона и все же является окисленным, а кислород выступает в качестве агента окисления. С другой стороны, атом кислорода приобретает часть электрона, а значит — восстанавливается, а восстановительным агентом является углерод.
Как видите, не бывает ни окисления самого по себе, ни восстановления самого по себе. В обычных химических реакциях электроны не могут существовать сами по себе, они могут лишь переходить от одного атома к другому, целиком либо частично. Атом, теряющий электрон, — окисляется, приобретающий — восстанавливается. Значит, окисляемое вещество всегда является агентом восстановления для второго участвующего в реакции вещества, а то, в свою очередь, — агентом восстановления для первого. Разумеется, это касается не всех реакций — если атомы распределяются поровну, как в случае образования молекулярного хлора из атомного, то в этом процессе нет ни восстановления, ни окисления.
Принимая во внимание неразрывную связь между окислением и восстановлением, химики дали такого рода реакциям двойное название «окислительно-восстановительных».
Так как же проходят с точки зрения перераспределения электронов реакции гидрогенизации и дегидрогенизации?
Эффект от потери водорода необходимо рассматривать по-разному, в зависимости от того, имела ли место также потеря электронов, поскольку для данного процесса это вопрос первостепенной важности. Иногда вещество высвобождает атом водорода вообще без «положенного» ему электрона. Водород, лишенный электрона, является положительно заряженным ионом водорода Н+. А остаток вещества становится, таким образом, отрицательно заряженным ионом, и весь процесс в целом получает название ионизации. Получило ли вещество в этом случае электрон и можно ли считать его подвергшимся «восстановлению»?
Правильный ответ — нет. Ион водорода высвобождается только в том случае, если его связь с неким совместно используемым электроном (общим, чаще всего, с кислородом) уже является столь слабой, что он просто «отпадает» от соединения. Он не теряет электрона в процессе ионизации, а остальная часть соединения — не приобретает его. Скорее следует признать факт свершившейся ионизации признаком того, что электрон уже перешел от водорода к остальной части вещества в результате каких-то предыдущих событий. Сама по себе ионизация не является ни окислением, ни восстановлением.
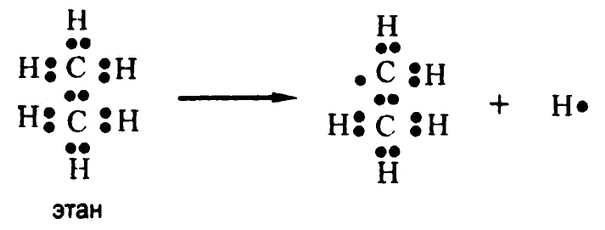
Рис. 54. Дегидрогенизация — электронная запись
Но, предположим, что атом водорода удален из соединения вместе со своим электроном. Такая ситуация представлена на рис. 54. (Вопрос о том, что происходит при этом с самим атомом водорода, отложим на потом. Сейчас рассмотрим только освободившуюся связь.)
Теперь можно сказать, что у органического вещества остался один электрон в полном распоряжении — а раньше было два, но в частичном. Поскольку атом углерода держит электроны чуть крепче, чем атом водорода, то когда у углерода и водорода было два совместно используемых электрона, на долю углерода приходилась чуть большая часть. Теперь же «чуть большая часть от двух», то есть «чуть более одного электрона», заменено на просто «один электрон». Значит, часть электрона соединение потеряло, и его можно счесть окисленным. Таким образом, дегидрогенизация остается окислительной реакцией и в новом, электронном понимании.
Следуя такой же логике, можно доказать и что потеря атома кислорода (хоть в одиночку, хоть в составе гидроксильной группы) вместе со всеми электронами предоставляет оставшейся части молекулы полный контроль над одним электроном вместо слабых попыток совместного с кислородом контроля над двумя электронами. Оставшаяся часть молекулы приобретает таким образом долю электрона, так что удаление из нее кислорода означает восстановление.
Но вернемся к дегидрогенизации, схема которой приведена на рис. 54. Обратите внимание, что после удаления атома водорода у углевода остается один непарный электрон. Группа атомов, обладающая непарным электроном, называется «свободным радикалом».
Свободные радикалы в таком виде пребывают недолго, поскольку оставшийся без пары электрон — очень нестабильное образование. Он вынужден искать себе пару, и вскоре обязательно с его участием происходит какая-нибудь химическая реакция.
Конечно, если удалить два атома водорода (каждый вместе со своим электроном), так что одновременно в одной молекуле образуются два непарных электрона, то они вполне могут найти себе пару в лице друг друга, образовав «двойную связь», как на рис. 55.
В большинстве случаев окисления органических веществ происходит действительно именно такая «двойная» дегидрогенизация — потеря двух атомов водорода. При такого рода дегидрогенизации происходит значительное снижение уровня свободной энергии — настолько значительное, что такие реакции, происходящие в процессе катаболизма, и представляют собой источник энергии для образования высокоэнергетических фосфатных связей.
Тем не менее при обычных условиях такого, как правило, не случается. Органическое вещество может существовать годами, и никакой дегидрогенизации с ним не происходит, пока оно не окажется в центре значительного изменения уровня свободной энергии.
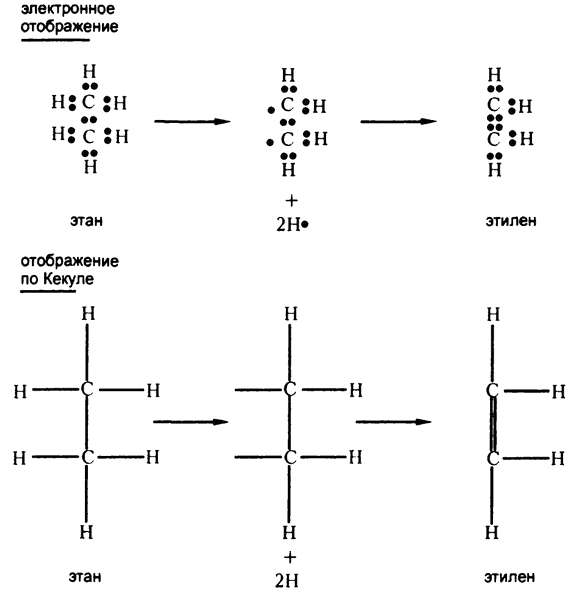
Рис. 55. Образование двойных связей
Понятно, что потребуется еще и значительное количество энергии активации. В 1935 году Михаэлис (тот самый, один из авторов формулы Михаэлиса— Ментена) указал, что крайне маловероятно, чтобы органическое соединение потеряло два атома водорода одновременно. Гораздо вероятнее, что сначала оно потеряет один атом, а потом — второй. То есть должна существовать некая промежуточная форма, когда один электрон уже утрачен, а второй — еще нет, и в этот момент вещество будет представлять собой свободный радикал.
Свободный радикал — нестабилен, а для его создания требуется приложить много свободной энергии. С потерей второго электрона энергозатраты более чем восполнятся; однако сначала все же надо оторвать первый электрон, а для этого надо найти энергию активации, и именно эта сложность и не дает всем органическим соединениям (включая те, из которых состоим мы сами) немедленно разложиться на воду и углекислоту.
Однако в тканях имеются ферменты, катализирующие дегидрогенизацию при комнатной температуре. Это делается за счет снижения энергетического содержания свободного радикала — его стабилизации, иными словами. Таким образом, энергия активации уменьшается до той точки, при которой кинетической энергии молекул при комнатной температуре оказывается достаточно, чтобы приводить к образованию свободных радикалов. Когда это происходит, то, разумеется, тут же теряется и второй атом водорода и образуется двойная связь.
Но каким же образом стабилизируется свободный радикал?
На протяжении всего XIX века химики пытались создать вещества, которые мы сейчас называем свободными радикалами и которые существовали бы хоть сколько-нибудь долго, но ничего у них не выходило. Получилось это, наконец, у американского биохимика Мозеса Гомберга только в 1900 году. Гомберг показал, что некоторые сложные свободные радикалы можно заставить существовать неопределенно долго, и об их существовании свидетельствует цвет раствора.
Первый созданный таким образом свободный радикал, трифенилметил, состоит из атома углерода, соединенного с тремя бензольными кольцами. (Сам бензол состоит из шести атомов углерода и шести атомов водорода, объединенных в симметричное замкнутое кольцо.) Все три бензольных кольца, как нам известно, находятся в одной плоскости и расположены симметрично относительно центрального атома углерода, как изображено на рис. 56.
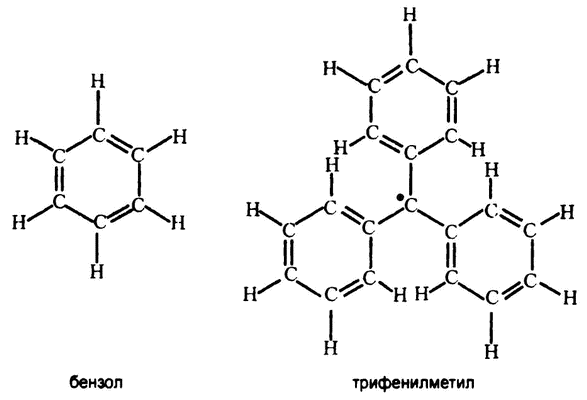
Рис. 56. Свободный радикал трифенилметил и его отношение к бензольному кольцу
Но с чего вдруг этот конкретный свободный радикал оказался таким стабильным? Впервые разумно объяснить это смог американских химик Лайнус Полинг только в начале 30-х годов XX века. Полинг взял на вооружение теории 20-х годов о том, что электрон — это не крошечный шарик, лишенный собственных свойств, а совокупность волн, способных размываться по большему или меньшему пространству, в зависимости от обстоятельств.
Основываясь на представлении о волновой природе электронов, Полинг разработал математическую теорию, которую назвал «теорией резонансов». Помимо прочего, с помощью этой теории он смог показать, что чем в большей степени непарный электрон способен размываться, тем более он стабилен.
Вероятность размывания электрона больше в тех случаях, когда молекула, в состав которой он включен, расположена в одной плоскости и симметрична. Трифенилметил Гомберга идеально удовлетворяет этим требованиям. На рис. 56 я изобразил непарный электрон в виде точки, но это уже не соответствует реальным представлениям химиков о природе электрона. Правильнее было бы изобразить его в виде-туманности, обволакивающей молекулу, с симметричными областями высокой концентрации на некоторых участках.
Михаэлис, услышав про теорию резонанса, указал, что соединение фермента с субстратом — гораздо более симметрично, чем молекула субстрата сама по себе. В таком случае свободный радикал субстрата, объединенного с ферментом, будет гораздо более устойчивым соединением, чем просто свободный радикал субстрата, и для образования свободного радикала из комплекса «субстрат-фермент» потребуется гораздо меньше энергии, чем для образования свободного радикала из просто субстрата, — именно за счет этого фермент столь успешно катализирует реакцию.
Вернемся же к судьбе тех двух атомов водорода, которые были удалены из органического вещества путем дегидрогенизации. Один из возможных вариантов — что они объединятся в молекулу газообразного водорода и улетят. Однако при дегидрогенизации органических веществ в живой ткани этого, как правило, не происходит, за исключением тканей нескольких видов бактерий.
Альтернативный вариант — атомы перейдут к некоей «принимающей» молекуле, которая, приобретя атомы водорода, таким образом «восстанавливается». В качестве варианта такой молекулы напрашивается кислород, значит, пора нам присмотреться к электронному строению этого элемента.
В атоме кислорода восемь электронов, два во внутренней оболочке и шесть — во внешней. В электронной записи этот атом можно отобразить так:

В обычных условиях этот атом в свободном виде не встречается, а существует по парам, составляющим молекулу кислорода. Логично предположить, что при этом у двух атомов формируется общее множество из двух пар электронов, так что в оболочке каждого из них оказывается вожделенная восьмерка:

Проблема в том, что кислород обладает, ко всему прочему, еще и сильным магнетическим действием, и химики уверены, что причиной тому — наличие непарных электронов. Так что более вероятной кажется вот такая картина:

Это уже два свободных радикала, которые тем не менее являются стабильными. Достаточно интересное исключение для тех, кто занимается теоретической химией, но мы сейчас в это углубляться не будем.
Такая молекула кислорода легко может принять два атома водорода следующим образом (привожу как «электронную», так и обычную запись):
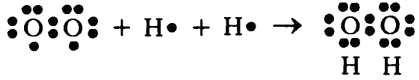
H2O2 — это перекись водорода, достаточно нестабильное соединение, имеющее тенденцию к расщеплению на воду и кислород:
2H2O2 ? 2H2O + O2.
Распад перекиси водорода — спонтанная реакция, представляющая уменьшение свободной энергии (рис. 57). Своей медленной скоростью (а хранить раствор перекиси водорода при низких температурах можно достаточно долго без значительных потерь) она обязана тому факту, что для распада необходимо разорвать связь О—О, а для этого нужна достаточно большая энергия активации.
Для получения этой энергии активации, а значит, и ускорения распада перекиси водорода достаточно даже слабого нагревания. Ряд химических веществ способны этот распад катализировать, например железные опилки или широко распространенный фермент каталаза.
Поскольку при переходе от перекиси водорода к воде уровень свободной энергии значительно снижается, то можно сказать, что при переходе от кислорода к воде уровень свободной энергии снижается сильнее, чем при переходе от кислорода к перекиси водорода. Следует ли в таком случае ожидать, что кислород, принимая водород, каждый раз будет образовывать воду?
Застревание происходит на этапе разрыва связи О—О. Если кислород соединяется с водородом при высоких температурах (к примеру, при сжигании смеси кислорода с водородом или сжигании же какого-нибудь органического соединения) связь кислорода с кислородом рвется без проблем и образуется вода.
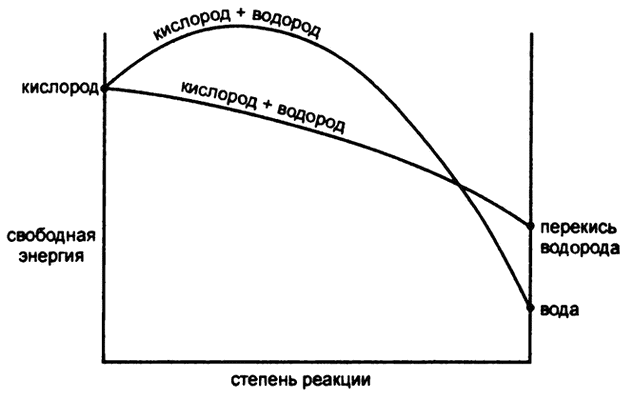
Рис. 57. Перекись водорода и вода
Если же кислород соединяется с водородом при комнатной температуре, как это случается при некоторых реакциях, катализируемых ферментами, на разрыв связи «кислород-кислород» энергии может и не хватить и вместо воды образуется перекись водорода.
Однако в живых тканях перекись водорода в каких-либо значительных концентрациях не встречается — и хорошо, потому что она очень ядовита. Одним из возможных тому объяснений служит присутствие каталазы. Ее действие может заключаться в том, что любая образующаяся молекула перекиси водорода тут же расщепляется с образованием воды. Однако, как мы вскоре увидим, вполне вероятно, что крупномасштабного образования перекиси водорода в организме вообще не происходит, а каталаза служит лишь для подстраховки и потребность в ней возникает нечасто.
Кислород, конечно, наиболее вероятный захватчик свободного атома водорода, но не единственно возможный. Атом водорода, который одно органическое вещество отпускает, может быть принят целым рядом других органических веществ.
Чтобы лучше понять этот факт, представим, что множество органических веществ могут существовать в двух формах — в восстановленной и окисленной, причем разница между ними будет заключаться в присутствии или отсутствии двух атомов водорода. Это можно выразить следующим образом:
АН2 ? А + 2Н.
ВН2 ? В + 2Н и так далее.
восстановленная форма ? окисленная форма
Окислительно-восстановительные реакции будут, естественно, разными для разных веществ. К примеру, у первой из вышеприведенных реакций точка равновесия может быть смещена вправо, так что АН2 будет иметь ярко выраженную склонность к потере двух атомов водорода. С другой стороны, у второй реакции точка равновесия может быть смещена влево, так что В будет иметь склонность к присоединению атомов водорода.
В таком случае, если смешать АН2 и В, то получим следующую реакцию:
АН2 + В ? ВН2 + А.
АН2, теряя атомы водорода, окисляется агентом окисления В. Само же В, приобретая водород, восстанавливается агентом восстановления АН2.
Теперь нам остается только разработать какой-то способ измерить склонность водорода перетекать от одного вещества к другому, и это даст нам возможность предсказать, какое из них будет окисляться, а какое — восстанавливаться.
Для этого необходимо вспомнить, что и потеря, и принятие атомов водорода на самом деле лишь один из аспектов потери и принятия электронов. Любое вещество, имеющее склонность раздавать электроны, оказывает «давление», посылающее их по электрической цепи. Такое давление является электрическим потенциалом. Можно установить электрические батареи типа I, о которых я говорил в главе 10, и измерить в вольтах электрический потенциал той или иной окислительной реакции. Привести их к определенным стандартным условиям — и мы получаем «окислительный потенциал».
Окислительный потенциал реакции, при которой атом водорода отдает один электрон и превращается в ион водорода, произвольно принят за ноль. Окислительный потенциал любого атома или молекулы, проявляющих меньшую склонность к тому, чтобы отдавать электрон, считается положительным, проявляющих большую склонность отдать электрон — отрицательным.
Любое вещество всегда будет принимать электроны (иногда вместе с атомами водорода в качестве бесплатного приложения) от другого вещества, имеющего меньший положительный (или вообще отрицательный) окислительный потенциал. И точно так же любое вещество будет отдавать электроны (иногда вместе с атомами водорода) другому веществу, имеющему больший положительный (или меньший отрицательный) окислительный потенциал.
Можно даже представить серию окислительно-восстановительных реакций с участием одних и тех же электронов или одних и тех же атомов водорода, переходящих от одного вещества к другому по цепочке последовательного уменьшения отрицательных и увеличения положительных окислительных потенциалов.
Именно так на самом деле и происходит в живой ткани — давайте же вернемся к ней.
| <<< Назад Глава 21. ЗНАЧЕНИЕ ФОСФАТОВ |
Вперед >>> Глава 23. ЖИЗНЬ С ВОЗДУХОМ |
- Глава 13. И СНОВА О ЖИВОЙ И НЕЖИВОЙ МАТЕРИИ
- Глава 14. С МАЛОЙ СКОРОСТЬЮ
- Глава 15. КАТАЛИЗАТОРЫ ЖИЗНИ
- Глава 16. ПОДРОБНЕЕ О БЕЛКАХ
- Глава 17. СЛАБОЕ ПРИТЯЖЕНИЕ
- Глава 18. КАК РАБОТАЮТ ФЕРМЕНТЫ
- Глава 19. ДЛЯ ЧЕГО ЖЕ ОНИ НУЖНЫ?
- Глава 20. ЖИЗНЬ БЕЗ ВОЗДУХА
- Глава 21. ЗНАЧЕНИЕ ФОСФАТОВ
- Глава 22. ПЕРЕДАЧА ЭЛЕКТРОНОВ
- Глава 23. ЖИЗНЬ С ВОЗДУХОМ
- Глава 24. ГДЕ СХОДЯТСЯ ВСЕ ПУТИ
- Глава 25. ОСНОВНОЙ И ГЛАВНЫЙ ИСТОЧНИК
- Способы освобождения электронов
- Глава 22. ПЕРЕДАЧА ЭЛЕКТРОНОВ
- Передача гормонального сигнала: синтез, секреция, транспорт гормонов, их действие на клетки-мишени и инактивация
- Синаптическая передача
- 30. Передача сообщений в прошлое
- Глава 30. Передача сообщений в прошлое
- ОТКРЫТИЕ ЭЛЕКТРОНОВ И КВАРКОВ
- Квантовое туннелирование электронов в биологии
- Служба вторичных электронов
- Глава пятая. Служба свободных электронов
- 16.1. Хранение, передача наследственной информации и расшифровка генома
- Движение свободных электронов
