Книга: Удивительный мир органической химии
6.5. От аммиака к аминам
| <<< Назад 6.4. Бензол и карбоксильная группа |
Вперед >>> Глава 7 Удивительные сочетания |
6.5. От аммиака к аминам
Наверное, многие слышали, что существует газ — аммиак. Вот его структурная формула:
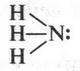
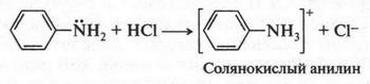
Аммиак — слабое основание. Этим он обязан неподеленной паре электронов на атоме азота (они обозначены в формуле двумя точками). Действительно, если на аммиак подействовать кислотой, то ее протон будет связываться с атомом азота при помощи этих электронов. В результате образуется соль:
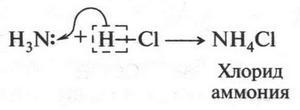
Аммиак — соединение неорганическое, но если атом водорода в молекуле аммиака заместить на радикал, то получим органическое вещество — амин (например, метиламин).
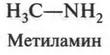
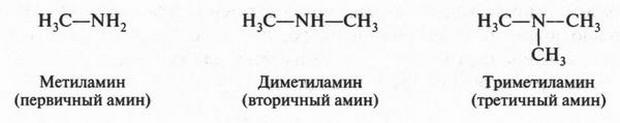
В зависимости от числа замещенных водородных атомов в молекуле аммиака различают амины первичные, вторичные и третичные.
Радикалы, замещающие водородные атомы, могут быть не только алифатическими, но и ароматическими, алициклическими и даже гетероциклическими.
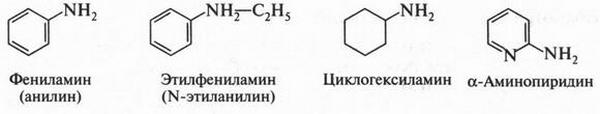
Для получения аминов существует много способов, но главные из них — реакция Гофмана (алкилирование аммиака) и восстановление нитросоединений. Рассмотрим эти реакции.
Алкилирование аммиака (замена атомов водорода в молекуле аммиака на радикалы) провел одновременно с А. Вюрцем немецкий химик Август Вильгельм Гофман (1818-1892), нагревая галогеноводороды с аммиаком:
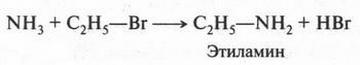
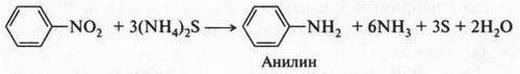
Восстановление ароматических нитросоединений в амины впервые осуществил в 1842 г. Н. Н. Зинин. Он действовал на нитробензол сульфидом аммония и получил ароматический амин — анилин:
Амины, будучи производными аммиака, имеют с ним много общего. Так, водные растворы аминов проявляют щелочную реакцию:
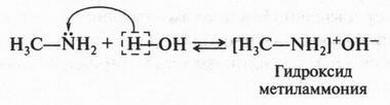
В этом случае протон связывается с атомом азота, а гидроксильная группа остается свободной. Она-то и определяет щелочные свойства. Таким образом, амины, как и аммиак, обладают основными свойствами. Это хорошо видно из электронного строения молекул аммиака и амина. В этих соединениях на атоме азота имеется неподеленная электронная пара, которая способна связывать протон.

Посмотрите, как это происходит:
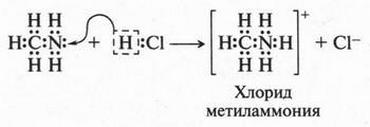
Эта реакция подтверждает сделанный ранее вывод: кислоты — это вещества, способные отдавать протон, а основания — вещества, присоединяющие его.
Итак, амины — органические основания. Но оказалось, что они обладают большей основностью, чем аммиак! Конечно, этот факт не является неожиданностью и его легко объяснить. Вся причина в углеводородном радикале, который связан с атомом азота. Этот радикал способен «отталкивать» от себя электронную плотность в сторону этого атома. В результате на нем создается избыточная электронная плотность, которая вместе с парой электронов азота прочно удерживает протон.
Низшие амины (метиламин, диэтиламин и др.) при обычных условиях — газы с неприятным запахом (запах испорченной рыбы), хорошо растворимые в воде. Высшие амины — твердые, нерастворимые в воде вещества без запаха.
Амины нашли применение в химической промышленности. Они используются в производстве препаратов для борьбы с вредителями сельского хозяйства, ускорителей вулканизации каучуков, ПАВ, лекарственных средств и красителей. Высшие амины используются даже в строительстве. Так, их вводят в уплотняющие составы, замазки, дорожные покрытия. Это улучшает прилипаемость материалов к влажным поверхностям.
Если в молекуле амина имеются две аминогруппы, то это — диамины. Например:
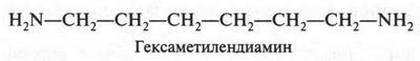
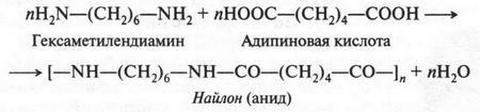
Этот диамин является одним из исходных веществ для получения важного полимера — найлона (анида):
Из ароматических аминов особое значение имеет анилин.
С историей открытия анилина связано несколько имен выдающихся химиков мира, которые независимо друг от друга открыли этот замечательный продукт. В 30-е гг. XIX в. немецкий химик Ф. Рунге начал интенсивные работы по изучению каменноугольной смолы. Германия сильно отставала от Англии в этих исследованиях. Это тревожило ученого, как патриота своей страны. Англия, в отличие от Германии, располагала большими запасами каменного угля. Хорошо поставленное шахтное дело позволило Англии наладить производственное получение кокса для металлургии, а светильный газ использовать для освещения городов. В то же время Германия даже во второй половине XIX в. вынуждена была закупать значительную часть каменного угля для пароходов и паровозов. Поэтому серьезные исследования по переработке каменноугольной смолы в этой стране почти не проводились. Ф. Рунге был первым химиком, который взялся за систематическое изучение этого продукта. В результате в каменноугольной смоле ученый обнаружил несколько новых органических соединений (пиррол, хинолин, розоловую кислоту и др.). В 1839 г. Ф. Рунге выделил ксианол, который, как оказалось, был получен еще в 1826 г. при перегонке индиго с известью и назван кристаллином. Этот же продукт получил в 1841 г. К. Фрицше при нагревании индиго с раствором едкого кали и назвал его анилином (от исп. анил — индиго). Через два года тот же продукт был получен Н. Н. Зининым при восстановлении нитробензола сульфидом аммония и назван бензидамом. Идентичность ксианола, кристаллика, анилина и бензидама была установлена в 1843 г. А. Гофманом. Оказалось, что все эти названия характеризуют один и тот же продукт — очень важный ароматический амин, за которым потом закрепилось одно название — анилин.
Обратите внимание, каким способом получали анилин эти ученые. Если Ф. Рунге выделил его из каменноугольной смолы (анилин содержится в ней в незначительных количествах), а двое других ученых — из красителя индиго, то Н. Н. Зинин

Реакция Зинина легла в основу производственных процессов, возникших в ХIХ в. в промышленности синтетических красителей, взрывчатых веществ, лекарственных препаратов и многих других соединений.
Анилин — бесцветная маслообразная жидкость, малорастворимая в воде. Легко окисляется кислородом воздуха. При этом она желтеет, а потом приобретает темно-бурый цвет.
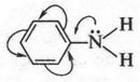
Химические свойства анилина определяются аминогруппой и бензольным кольцом. Как и в случае обычных аминов, атом азота имеет неподеленную пару электронов, которые способны присоединять протон кислоты:
Как видите, анилин также обладает основными свойствами. Однако они выражены гораздо слабее, чем у аммиака, а тем более у алифатических аминов. Это можно объяснить тем, что неподеленная электронная пара на атоме азота в молекуле анилина вступает во взаимодействие с ?-электронами бензольного кольца. В результате этого электронная пара несколько смещается в сторону кольца, а атом азота приобретает более положительный характер. Поэтому его склонность к присоединению протонов снижается.
Анилин вступает в те же реакции, что и алифатические амины. Однако у него имеются и свои особенности. Например, он легко окисляется. При этом, как говорилось выше, анилин даже на воздухе меняет свой цвет до темной окраски. Но особенно легко анилин окисляется под влиянием сильных окислителей. В этом случае он превращается в «черный анилин» — краситель черного цвета. Особенно легко окисляются ароматические диамины (например, фенилендиамин). Продукты, которые при этом образуются, используют для окраски искусственного меха в черный цвет, а также в косметике (краситель «урсол»).
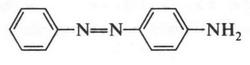
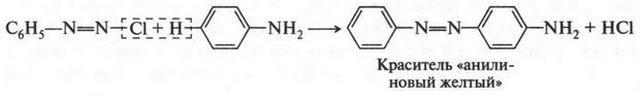
Из анилина можно получать много очень ценных веществ. Это — анилиновые красители, лекарственные препараты, фотоматериалы, полимеры и др. Например, число анилиновых красителей (азокрасителей) в настоящее время превышает 2 тыс. Первый и самый простой азокраситель — «анилиновый желтый» был получен в 1861 г.
Сама реакция (реакция диазотирования), благодаря которой стало возможным получение азокрасителей, была открыта немецким химиком Петером Гриссом (1829-1888) раньше — в 1858 г. Вот эта реакция:
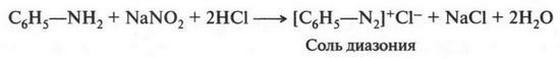
В результате взаимодействия образовавшейся соли диазония с ароматическими аминами или фенолами получают азокрасители.
Приведем пример еще одного азокрасителя — «метилового оранжевого»:
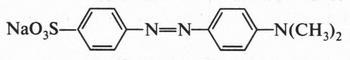
Окраска этого красителя меняется в зависимости от характера раствора: в щелочной и нейтральной среде его цвет желтый, а в кислой — красный. Поэтому такой краситель применяют в качестве индикатора (метилоранж).
Несмотря на то что сам анилин — довольно ядовитое вещество (разрушает красные кровяные тельца), его некоторые производные находят применение в медицине. Наверное, вы слышали о препарате — фенацетине, который раньше использовали в качестве жаропонижающего и болеутоляющего средства:
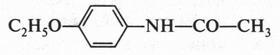
В наши дни фенацетин заменил близкий по строению парацетамол:
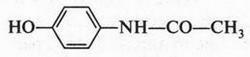
| <<< Назад 6.4. Бензол и карбоксильная группа |
Вперед >>> Глава 7 Удивительные сочетания |
- 138. Фиксация атмосферного азота. Получение аммиака.
- Межклеточное вещество
- 04. На что влияет нагрев планет звездами, звезд Ядрами Галактик, Ядер Галактик Ядрами Сверхгалактик
- Список литературы
- Разные человечества
- Красные тучи, закрывающие солнце
- Московская белая
- Муравей, семья, колония
- Примерные рационы для котят от месяца до пяти и старше
- Голосеменные растения завоевывают мир
- Пароль скрещенных антенн
- Позор страны
