Книга: Удивительный мир органической химии
6.3. Муравьиная кислота и ее «родственники»
| <<< Назад 6.2. О кислотах и основаниях |
Вперед >>> 6.4. Бензол и карбоксильная группа |
6.3. Муравьиная кислота и ее «родственники»
Вот теперь продолжим разговор о карбоновых кислотах — основных кислотах органической химии. Сразу же отметим, что карбоновых кислот много и все они разные. Мы же расскажем только о некоторых, наиболее известных и важных.
Наш рассказ начнем с муравьиной кислоты.
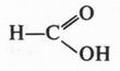
В молекуле этой кислоты карбоксильная группа связана не с радикалом, а с атомом водорода. Среди карбоновых кислот муравьиная кислота — самая сильная. Она почти в 10 раз сильнее всех остальных карбоновых кислот.
Муравьиная кислота содержится в некоторых растениях (крапиве, хвое и др.) и насекомых (в выделениях муравьев и пчел). Многие из вас не раз смогли убедиться в раздражающем действии муравьиной кислоты. При укусе лесного красного муравья вы испытали болезненное ощущение потому, что он впускает в ранку почти незаметное количество муравьиной кислоты. Кстати, само название — муравьиная — связано с муравьями, из которых эта кислота была впервые выделена. По той же причине жгутся листья крапивы, если их неосторожно задеть рукой.
Муравьиная кислота — бесцветная жидкость с резким запахом. Впервые ее получил Т. Пелуз в 1831 г. из синильной кислоты. Сейчас муравьиную кислоту получают пропусканием оксида углерода (II) через расплавленный гидроксид натрия:
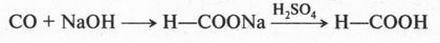
Как видите, вначале образуется соль кислоты (формиат натрия), а затем при действии на эту соль кислотой выделяют муравьиную кислоту в свободном виде.
Муравьиная кислота не только самая сильная в ряду одноосновных карбоновых кислот (одноосновных — значит с одной карбоксильной группой), но и наиболее активная. Действительно, если посмотреть на ее молекулу несколько иначе, то мы увидим... альдегидную группу.
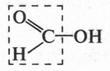
Поэтому муравьиная кислота проявляет не только кислотные свойства, но и восстанавливающие. Так, она восстанавливает серебро из оксида серебра:
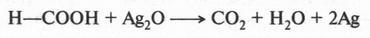
Такая реакция называется реакцией «серебряного зеркала». Название возникло потому, что если реакцию проводить в пробирке, то на ее стенках можно увидеть налет серебра («зеркало»).
При нагревании до 160 °С муравьиная кислота разлагается:

Как и все карбоновые кислоты, эта кислота со спиртами (в присутствии серной кислоты) образует сложные эфиры, а со щелочами — соли.
Муравьиную кислоту используют в текстильной промышленности в качестве протравы при крашении тканей, в кожевенной — при дублении кож, в пищевой — для консервирования фруктов, а также в производстве некоторых полимеров. Кроме того, муравьиная кислота — хороший растворитель для многих полимеров (капрона, найлона, поливинилхлорида и др.). Не обходится без этой кислоты и медицина.
Если о муравьиной кислоте многие только слышали, то о другой кислоте — уксусной — знают все.
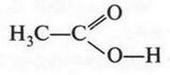
В формуле этой кислоты карбоксильная группа связана не с атомом водорода, а с радикалом (метильной группой).
Уксусная кислота известна человеку с незапамятных времен. Правда, в чистом виде ее выделили только в 1700 г., но еще до этого кислота часто использовалась в виде водного раствора. В 1845 г. ее получил синтетическим путем Г. Кольбе. Уксусная кислота образуется и «самопроизвольно» — при окислении спирта под влиянием особых бактерий (все слышали о скисании вина). В промышленности наиболее выгодным способом получения уксусной кислоты является прямое окисление бутана:
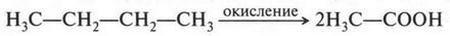
Уксусная кислота — бесцветная жидкость с резким кисловатым запахом. Если эта кислота не содержит воду, то при 16,6 °С она «замерзает» — образует бесцветные кристаллы. Такая кислота называется ледяной. В свое время ее изучал итальянский химик Костанцо Бонвичино (1739-1812). Водный раствор (70-80%) кислоты известен как уксусная эссенция, а 5-7%-й раствор называется столовым уксусом.
Уксусная кислота часто встречается в природе. Она содержится в некоторых растениях, моче, поте, желчи. Даже человеческий организм служит своеобразной «фабрикой» по выработке уксусной кислоты. За сутки с мочой выделяется 0,5 кг кислоты. Все продукты, содержащие углеводы, в процессе обмена веществ превращаются в кислоту.
Уксусная кислота — слабая кислота. Однако она изменяет цвет лакмуса в красный. От муравьиной кислоты она отличается не только меньшей «силой», но и отсутствием восстанавливающих свойств (она ведь не содержит альдегидной группы). Но «силу» кислоты можно повысить. С этой целью атом водорода в метильном радикале заменяют на атом хлора (или любого галогена). Полученная хлоруксусная кислота Сl—СН2—СООН проявляет сильные кислотные свойства. Если же заменить все атомы водорода на атомы хлора, то трихлоруксусная кислота Сl3С—СООН по силе не уступает некоторым минеральным кислотам.
Уксусная кислота служит для получения полимеров, красителей, сложных эфиров, ацетатного шелка, негорючей фото- и кинопленки ит. д. Находят применение и ее некоторые соли. Так, ацетаты железа, алюминия, хрома используют в качестве протравы при крашении тканей; ацетат свинца — для изготовления свинцовых белил, а ацетат меди (II) — для борьбы с вредителями сельского хозяйства.
Наряду с муравьиной и уксусной кислотами существуют и другие. В молекулах этих кислот содержатся радикалы, которые различаются длиной углеродной цепи. Так, масляная кислота в молекуле содержит три углеродных атома.
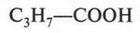
В свободном виде эта кислота обнаружена во многих растениях, грибах, а также в поте. Она входит даже в состав некоторых жиров, но не в больших количествах (например, в коровьем масле ее 3-4%). С неприятным запахом масляной кислоты связан специфический вкус и запах прогорклого масла.
Получают эту кислоту окислением бутилового спирта или сбраживанием отходов, содержащих крахмал (под действием особых микробов). Масляную кислоту часто используют для получения сложных эфиров, некоторые из которых применяют в пищевой промышленности (для придания фруктового запаха).
Существуют и другие кислоты, запах которых также никак нельзя отнести к приятным. Это капроновая (С5Н11—СООН), каприловая (С7Н15—СООН) и каприновая (С9Н19—СООН) кислоты. Название этих кислот имеет общий корень — «капр» (от лат. козел), названию соответствует запах. В виде триглицерида (т. е. сложных эфиров, образованных глицерином и карбоновыми кислотами) эти три кислоты входят в состав коровьего и козьего, а также кокосового масел. Однако необходимо отметить, что масляная, капроновая, каприловая и каприновая кислоты входят в состав немногих жиров. В этом случае они скорее исключение. Тогда возникает вопрос: какие же кислоты входят в состав других жиров? Оказалось, что при гидролизе большинства жиров образуются карбоновые кислоты с более длинными радикалами, в состав которых входит большое число углеродных атомов. Чаще такими кислотами являются пальмитиновая (С15Н31—СООН), стеариновая (С17Н35—СООН) и олеиновая (С17Н33—СООН) кислоты. Первая кислота так названа потому, что впервые была выделена из пальмового масла, название второй происходит от греческого слова «твердый», а название третьей связано со словом «жидкое». Кислоты, содержащие в радикале свыше десяти углеродных атомов, называют высшими кислотами. Вот эти кислоты и входят в виде триглицеридов в состав большинства жиров. Если омылить эти жиры, то можно обратно получить высшие карбоновые кислоты. Однако в настоящее время эти кислоты получают окислением высших алканов (парафинов). Так, из 1 т алканов можно получить около 600-700 кг кислот. Смесь твердых пальмитиновой и стеариновой кислот получила название стеарина. Этот продукт часто используют для изготовления стеариновых свечей.
Высшие карбоновые кислоты обладают теми же химическими свойствами, что и обычные кислоты. Они образуют соли, сложные эфиры и другие соединения. Растворяются в органических растворителях, но нерастворимы в воде. С водными растворами щелочей образуют соли, которые называются мылами:
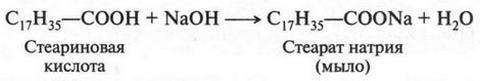
Натриевые и калиевые соли этих кислот (мыла) хорошо растворяются в воде (гидролизуются):

Таким образом, мыла — это соли высших карбоновых кислот. Обычное твердое (кусковое) мыло — это смесь натриевых солей пальмитиновой и стеариновой кислот.
О значении мыла знают все. С помощью мыла мы умываемся, купаемся. Мыло — страшный враг всех микробов. По годичному потреблению мыла судят о культуре нации. Еще не так давно мыло использовалось для стирки тканей. Мы и сейчас иногда применяем мыло для этих целей. Его называют хозяйственным. Почему же мыло удаляет загрязнения с рук, тканей и предметов? Дело в том, что оно обладает особым свойством — снижает поверхностное натяжение воды. Что это значит?
Молекулы мыла R—COONa (или К) состоят из двух частей: большого углеводородного радикала (С12—С18), обладающего водоотталкивающими свойствами, и полярной группы COONa (или К), растворимой в воде. Такую молекулу можно изобразить в виде палочки с утолщением на конце («головастик»). Палочка обозначает длинную углеводородную цепь, а утолщение на ее конце — полярную группу. При растворении мыла в воде его молекулы ориентируются таким образом, что нерастворимая часть молекулы выталкивается из воды, а растворимая погружается в нее (рис. 24). Такая ориентация молекул на границе воздух — вода приводит к снижению поверхностного натяжения воды{Поверхностное натяжение — свойство жидкости (например, воды) принимать форму с минимальной поверхностью.}. Это, в свою очередь, увеличивает смачивающую поверхность ткани или предмета. В результате — моющее действие увеличивается.
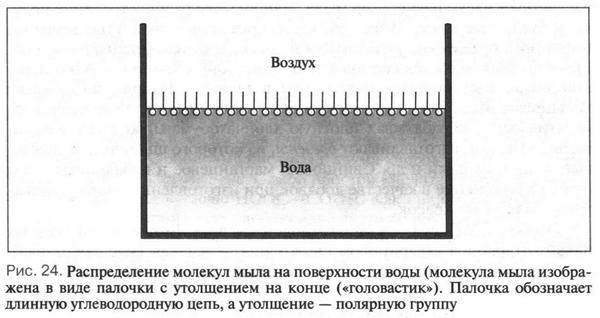
Следует сказать, что соли высших карбоновых кислот с числом углеродных атомов меньше десяти моющим действием не обладают, а с большим (свыше 20) трудно растворяются в воде. Поэтому оптимальное число углеродных атомов в высших карбоновых кислотах 12-18. Растворимость мыла в воде зависит также и от катиона: калиевое мыло («жидкое мыло») растворяется лучше, чем натриевое, а соли кальция, магния, бария и др. в воде нерастворимы. Поэтому моющая способность обычных мыл в жесткой воде, содержащей соли кальция и магния (например, морская вода), сильно падает. Это понятно, так как в такой воде ион натрия (или калия) замещается на кальций или магний. В результате образуются нерастворимые в воде кальциевые или магниевые мыла, которые выпадают в осадок в виде хлопьев:
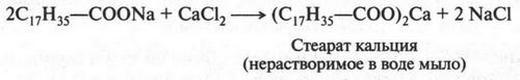
Существует несколько сортов мыла. Наибольшее распространение получили туалетные мыла. В них добавляют различные душистые вещества (отдушки), красители, антисептики и другие добавки. Специальные сорта мыла входят в состав кремов для бритья, зубных паст и т. д. А вот нерастворимые мыла нашли применение в технике. Например, добавляя кальциевое мыло в нефтяные масла, получают смазки для автотранспорта (солидол), а обрабатывая плотную хлопчатобумажную ткань алюминиевым мылом, изготавливают брезент, из которого шьют чехлы, дождевые плащи, палатки и др. Свинцовое, марганцевое и кобальтовое мыла нашли применение в качестве добавок при изготовлении олифы (сиккативы), масляных красок.
Особо следует сказать об олеиновой кислоте. В отличие от твердых пальмитиновой и стеариновой кислот она — жидкая (маслообразная), но на холоде твердеет. В молекуле этой кислоты содержится одна двойная связь:
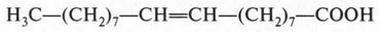
Поэтому она легко присоединяет по месту двойной связи водород и галогены. При восстановлении олеиновая кислота переходит в предельную кислоту — стеариновую:
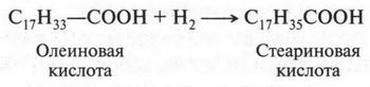
Олеиновую кислоту получают омылением некоторых растительных масел.
Известны еще более непредельные кислоты — линолевая и линоленовая. Они также входят в состав растительных масел. В молекуле линолевой кислоты содержатся две двойные связи, а в молекуле линоленовой кислоты — три:
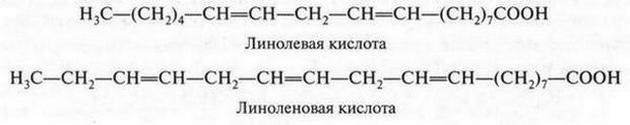
Эти кислоты — жидкости. Они легко окисляются и полимеризуются. При восстановлении превращаются в стеариновую кислоту. Эти кислоты крайне необходимы для нормальной деятельности живого организма и конечно же должны содержаться в пище. Их относят к незаменимым карбоновым кислотам. Поэтому растительные масла, содержащие их, являются ценными продуктами (особенно для людей пожилого возраста). Они способствуют удалению холестерина и повышают эластичность стенок кровеносных сосудов.
В рассмотренных нами кислотах содержится одна карбоксильная группа. Такие карбоновые кислоты называются одноосновными. Однако известны кислоты, в молекулах которых имеются две и более карбоксильных групп. Карбоновые кислоты с двумя карбоксильными группами называются двухосновными. Самой простой кислотой такого строения является щавелевая кислота НООС—СООН. Как видите, молекула этой кислоты — соединение двух карбоксильных групп друг с другом.
Впервые щавелевая кислота была обнаружена в кислом щавеле (конский щавель) в виде кислой калиевой соли, а в 1776 г. она была получена в свободном виде. В 1824 г. щавелевую кислоту синтезировал Ф. Вёлер при взаимодействии дициана с водой:
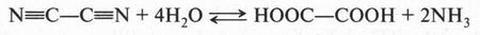
Известно, что ни сам Ф. Вёлер, ни его современники не обратили особого внимания на этот синтез. А ведь при этом происходило превращение неорганического вещества в органическое!
В промышленности щавелевую кислоту получают при нагревании натриевой соли муравьиной кислоты (формиата натрия):
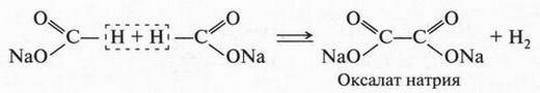
Затем на соль — оксалат натрия — действуют серной кислотой и получают свободную щавелевую кислоту.
Щавелевая кислота — довольно сильная кислота. По кислотным свойствам она превосходит даже муравьиную кислоту. Обладает всеми свойствами карбоновых кислот. Но у нее есть и особые свойства: она известна как восстановитель. Поэтому ее используют для отбеливания тканей, в производстве красителей, применяют в кожевенной и деревообрабатывающей промышленности. Она может удалять ржавчину и накипь. Без этой кислоты не обходится и пищевая промышленность, но применять ее как пищевую добавку нужно осторожно: она связывается в кишечнике с кальцием, образуя нерастворимые соли. Это приводит к тому, что кальций — важнейший элемент для организма — не всасывается в кровь.
Наш рассказ о карбоновых кислотах был бы неполным, если мы обойдем другие, не менее интересные, кислоты. Представьте себе, что в молекуле щавелевой кислоты две карбоксильные группы разделены одной двойной связью:
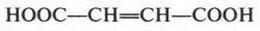
Эту непредельную двухосновную кислоту называют этилендикарбоновой кислотой. Эта кислота существует в виде двух изомеров, которые различаются пространственным строением. Эти изомеры представляют собой две различные кислоты. Одна из них (реформа) называется малеиновой кислотой, другая (трансформа) — фумаровой кислотой.

Еще в 1838 г. Ю. Либих обратил внимание на то, что эти кислоты отличаются по химическим свойствам, хотя и имеют одну и ту же эмпирическую формулу. Это оставалось загадкой до 1874 г., когда Я. Вант-Гофф на основе теории тетраэдрического углеродного атома объяснил причину различия свойств этих кислот.
Малеиновая кислота, в отличие от фумаровой, теряя воду, легко образует малеиновый ангидрид:
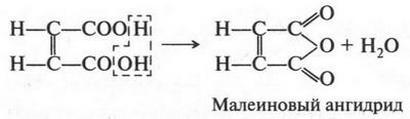
А вот фумаровая кислота так легко ангидрид не образует. Почему? Очень просто: две карбоксильные группы, от которых отщепляется молекула воды, расположены далеко друг от друга.
Кроме этого, у этих кислот имеются и другие отличия. Так, малеиновая кислота токсична, а фумаровая нет. Она наряду с лимонной, винной и яблочной кислотами используется в пищевой промышленности (например, в США при приготовлении напитков).
Малеиновая кислота содержится во многих растениях, в особенности в грибах и лишайниках. Применяется для получения различных ПАВ, а также в качестве антиокислителя для жиров. Что же касается фумаровой кислоты, то она идет на производство синтетических высыхающих масел и пластификаторов.
| <<< Назад 6.2. О кислотах и основаниях |
Вперед >>> 6.4. Бензол и карбоксильная группа |
- Малая панда и её родственники в Америке
- Родственники ли осел и лошадь?
- Яблочная кислота полезна для здоровья
- Секреты «корабля пустыни» и его родственники в америке
- Вулканоиды – родственники Вулкана
- 10. Его родственники — живые дьяволы
- Лягушкины родственники
- Колючие родственники
- НЕУЗНАВАЕМЫЕ РОДСТВЕННИКИ
- 17. Родственники человека
- 3.32. «ДРЕВЕСНАЯ КИСЛОТА». «КРИМИНАЛЬНОЕ» ПРОИСХОЖДЕНИЕ БЕНЗОЛЬНОГО КОЛЬЦА
- 3.28. КАК ПОЯВИЛОСЬ НАЗВАНИЕ «ЛИМОННАЯ КИСЛОТА»
