Книга: Удивительный мир органической химии
6.1. Союз двух групп
| <<< Назад Глава 6 Два противоположных мира |
Вперед >>> 6.2. О кислотах и основаниях |
6.1. Союз двух групп
Итак, водородный атом гидроксильной группы может иметь различную подвижность в зависимости от того, с чем связана эта группа. Например, в молекуле фенола этот водород гораздо подвижнее, чем в молекуле спирта. Поэтому спирт — вещество нейтральное, а фенол — слабокислое. Но, как известно, водород гидроксила может стать еще «кислее», т. е. подвижнее. Помните пикриновую кислоту? На усиление кислотных свойств в ней «работают» три нитрогруппы. Но есть вещества, в которых в качестве таких «усилителей» может быть карбонильная группа:
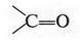
Попробуем мысленно связать гидроксильную группу с карбонильной. В результате получим новую группу следующего строения:
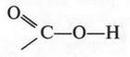
Такая группа существует в действительности и входит в состав карбоновых кислот. Ее называют карбоксильной группой. Это название вполне объяснимо. Оно произошло в результате слияния двух групп карбонильной («карб») и гидроксильной («окси»). Так появился химический термин — карбоксигруппа.
Для того чтобы узнать, как «работает» карбоксильная группа, мы снова расчленим ее на две составляющие — гидроксильную и карбонильную — и рассмотрим их в отдельности. Но сейчас эта задача намного упрощается. О гидроксильной группе мы многое знаем. Например, то, что она ведет себя по-разному в зависимости от того, с чем она связана. Например, в спиртах она одна, а в фенолах — другая. Но изменится ли что-нибудь, если в этих веществах между радикалами (алифатическими или ароматическими) и гидроксильной группой «внедрить» карбонильную группу? Но не будем спешить. Ведь мы не знаем еще строение карбонильной группы, которая должна усилить кислотные свойства гидроксила.
Карбонильная группа содержит двойную связь, которая, как и в алкенах, состоит из ?- и ?-связей. Но в отличие от этиленовой двойной связи она достаточно поляризована (атом кислорода более электроотрицателен, чем атом углерода), поэтому ?-электронная плотность в ней смещена в сторону атома кислорода:
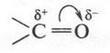
Установлено также, что полярность карбонильной группы в 6 раз выше, чем гидроксильной группы. Это очень важно! Если гидроксильную группу соединить с карбонильной, то последняя будет усиливать поляризацию связи О—Н. А это приводит к тому, что гидроксильная группа будет достаточно легко отщеплять водород в виде протона:
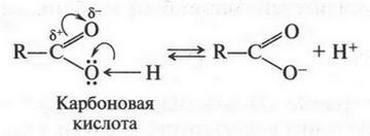
Так протекает процесс, который называется кислотной диссоциацией. Почему кислотной? Потому что соединение, в молекуле которого радикал связан с карбоксильной группой (гидроксильная + карбонильная), будет уже карбоновой кислотой.
Однако карбоновые кислоты — слабые кислоты. Конечно, по кислотным свойствам они превосходят фенол, но очень сильно уступают многим минеральным кислотам (серной, азотной, соляной и другим). По силе карбоновые кислоты проигрывают им в миллионы раз.
Мы начали рассказ о карбоновых кислотах. Но прежде давайте ответим на главный вопрос: какие вещества называют кислотами, а какие — основаниями?
| <<< Назад Глава 6 Два противоположных мира |
Вперед >>> 6.2. О кислотах и основаниях |
- Межклеточное вещество
- 04. На что влияет нагрев планет звездами, звезд Ядрами Галактик, Ядер Галактик Ядрами Сверхгалактик
- Список литературы
- Разные человечества
- Красные тучи, закрывающие солнце
- Московская белая
- Муравей, семья, колония
- Примерные рационы для котят от месяца до пяти и старше
- Голосеменные растения завоевывают мир
- Пароль скрещенных антенн
- Позор страны
- Что такое водопад?
