Книга: Удивительный мир органической химии
3.2. Всегда ли двойная связь прочнее?
| <<< Назад 3.1. Тетраэдр — «подарок» природы |
Вперед >>> 3.3. Всем известный ацетилен |
3.2. Всегда ли двойная связь прочнее?
Житейский опыт подсказывает, что двойная связь прочнее. Действительно, если морское судно привязано к пирсу двумя канатами, то это надежнее, чем если оно прикреплено одним. Но, оказывается, это не всегда так. Дело в том, что наши представления о прочности связей в бытовом плане неприменимы к другим связям — химическим. Поэтому двойная и даже тройная связь между углеродными атомами в органических молекулах вовсе не делает эту связь более прочной. Более того, такая связь будет менее прочной, чем одинарная. Но чтобы это понять, поговорим о самом простом органическом веществе, в молекуле которого углеродные атомы связаны двойной связью. Это — этилен. Этилен — бесцветный газ со сладковатым запахом, является составной частью природного или попутного газов (правда, в природном газе содержание этилена невелико — 0,5-4%).
Впервые этилен был получен в 1669 г. немецким химиком Иоганном Иоахимом Бехером (1635-1682). Однако изучение этого газа началось приблизительно через сто лет после его открытия. Все это время этилен был известен под названием «воздух Бехера». В 1795 г. голландские химики во главе с Иоганном Рудольфом Дейманом (1743-1808) подробно описали способ получения этого «воздуха» из этилового спирта и серной кислоты, а также его свойства. Они установили, что «воздух Бехера» состоит из углерода и водорода, легко вступает в реакцию с хлором, образуя маслянистую жидкость, названную потом «маслом голландских химиков». Как оказалось, это был 1,2-дихлорэтан ClСН2—СН2Cl. Позже «воздух Бехера» назвали олефиновым газом (т. е. маслородным). Кстати, олефинами стали называть и другие углеводороды, которые своими свойствами напоминали олефиновый газ, а последнему дали название — этилен. Под таким названием мы его и знаем.
Если метан — «родоначальник» алканов, то этилен дает начало другим углеводородам — этиленовым (алкенам). Эти соединения также образуют свой гомологический ряд, который имеет общую формулу СnН2n. Если ее сравнить с общей формулой для алканов (СnН2n+2), нетрудно заметить разницу: молекулы алкенов содержат на два водородных атома меньше. Поскольку молекула этилена содержит два атома углерода и четыре атома водорода, то его эмпирическая формула будет С2Н4. Однако эта формула не дает представления о строении этилена. Поэтому попытаемся изобразить возможные структуры для формулы С2Н4.
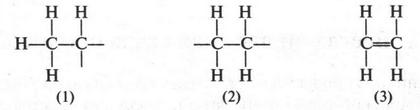
Придется сразу отказаться от структур (1) и (2), как нереальных. Действительно, они имеют по две свободные валентности, а это означает, что такие соединения будут крайне неустойчивыми. А ведь этилен — вещество вполне устойчивое и способно существовать сколько угодно времени. Таким образом, остается структура (3) с двойной связью между углеродными атомами. Как оказалось впоследствии, именно эта структура и выражает строение молекулы этилена. Итак, этилен — соединение с двойной связью между углеродными атомами.
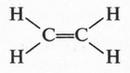
Две черточки между углеродными атомами означают, что связь образовалась в результате обобществления двух пар электронов, т. е. двойную связь можно представить так:
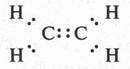
Следует сказать, что обозначение двойной связи при помощи двух черточек ввел немецкий химик Эмиль Эрленмейер (1825-1909).
Двойная связь в молекуле этилена — настоящая ахиллесова пята этого соединения. Это тот случай, когда двойная связь — «хуже», чем одинарная. Действительно, если алканы — довольно устойчивые соединения, вступающие в основном только в реакции замещения, то этилен и его гомологи — очень активные вещества, для которых характерны реакции присоединения. Например, если через водный раствор брома (бромная вода) пропустить этилен, то красновато-бурый цвет раствора исчезнет. Это означает, что произошла реакция. Химики установили, что в этом случае молекула брома присоединилась к этилену:
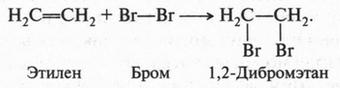
В полученном продукте (1,2-дибромэтан) отсутствует двойная связь между углеродными атомами. То же самое происходит, если к этилену присоединить молекулу хлора (помните «масло голландских химиков» — 1,2-дихлорэтан?). Если к этилену присоединить молекулу водорода (в присутствии катализатора — платины), то получим предельный углеводород — этан, который, как нам известно, двойной связи не содержит:
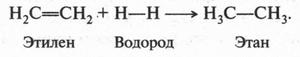
Этилен легко взаимодействует и с галогеноводородами, образуя галогенопроизводные:
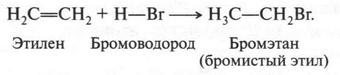
Этилен присоединяет даже воду. Правда, это происходит только в присутствии серной кислоты:
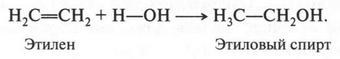
Вот так можно получить этиловый спирт.
Итак, в молекулах полученных веществ исчезла двойная связь! Это означает только одно: при реакциях присоединения происходит разрыв одной из связей между углеродными атомами и за счет освободившихся валентностей идет присоединение другой молекулы. Но это значит, что две связи, обозначаемые одинаковыми черточками, вовсе не одинаковы. Одна из них более прочная (она не разрывается), а вторая — более «ранимая» — разрывается:
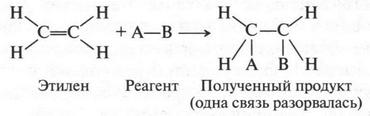
А вот теперь самый интересный вопрос: какая же связь сохранилась, а какая разорвалась? Если допустить, что двойная связь — сумма двух простых a-связей, то обе они не будут так легко разрываться при реакциях присоединения. Они будут вести себя так, как ведут обычные связи в алканах. Например, в молекуле этана. При этом добавим, что для них будут характерны реакции замещения, а не присоединения. Значит, двойная связь — это сумма разных по характеру связей. Но чтобы все это стало понятным, нам надо опять прибегнуть к теории гибридизации (видите, как она нас выручает!).
Давайте вспомним, что атом углерода в алкенах находится в состоянии sp2-гибридизации. Это означает, что из четырех орбиталей атома углерода (одна 2s и три 2р) гибридизованы только три: одна 2s- и две 2р-орбитали. Эти орбитали, перекрываясь, образуют три обычные а-связи — одну С—С и две С—Н. Итак, одну С—С-связь мы установили. Это обычная ?-связь. А другая? Для этого продолжим наши рассуждения.
При гибридизации четвертая 2p-орбиталь осталась неизмененной (в виде объемной восьмерки), т. е. негибридизованной. Она располагается в плоскости, которая перпендикулярна другой плоскости, в которой находятся три гибридизованные sp2-орбитали. Поскольку в молекуле этилена два атома углерода, то все сказанное относится и ко второму углеродному атому. Эти две негибридизованные орбитали (по одной от каждого углеродного атома) при перекрывании друг с другом образуют новую химическую связь, которую химики называют ?(пи)-связью. Отметим, что эта связь образована, как и обычная ?-связь, в результате обобществления электронов, но электронов «чистых», а не гибридизованных. Такие 2р-электроны называются ?-электронами. При этом очень важно отметить, что перекрывание орбиталей этих электронов происходит не в «лобовых» областях, в которых электронная плотность гораздо выше, а в «боковых», в которых она меньше. Но это означает, что образованная ?-связь будет менее прочной (чем полнее перекрывание орбиталей, тем прочнее связь). Вот почему при химических реакциях (при действии химических реагентов) ?-связь будет легче разрываться.
Что же происходит с двумя другими гибридизованными орбиталями (всего-то их четыре, если учитывать два углеродных атома)? Они, перекрываясь с 1s-орбиталями атомов водорода, образуют две одинаковые ?-связи С—Н. Как видно из рисунка 15, эти связи расположены в одной плоскости под углом 120° друг к другу.
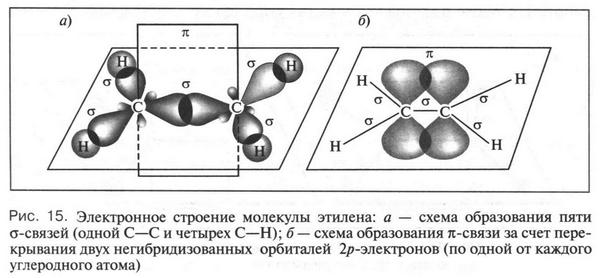
Сделаем важный вывод: символ из двух одинаковых черточек между углеродными атомами (двойная связь) в молекуле этилена означает комбинацию одной ?- и одной ?-связи. Такое строение двойной связи находит подтверждение в особом виде изомерии, характерной только для этиленовых углеводородов. Эту изомерию назвали цис-, трансизомерией. Почему эта изомерия характерна только для этиленовых углеводородов?
Установлено, что вокруг простой a-связи возможно относительно свободное вращение атомов и атомных группировок. Но если углеродные атомы связаны двойной связью, то такое вращение невозможно. Этому мешает ?-связь, которая образована перекрыванием двух негибридизованных 2р-орбиталей. Если «поворачивать» одну группу СН2 относительно другой, то 2р-орбитали будут выходить из состояния «внедрения» друг в друга. Но это означает, что ?-связь разрушается! Чтобы этого не происходило, двойная связь (а точнее, ?-связь) не допускает поворотов, т. е. атомы или группы атомов, которые связаны с углеродными атомами, строго фиксированы в пространстве. Поэтому, например, молекула бутилена (бутен-2) может находиться в виде двух пространственных изомеров.
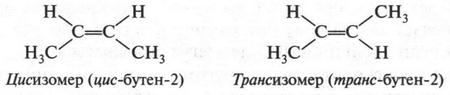
Изомеры, в молекулах которых радикалы (в данном случае метальные группы) расположены по одну сторону от двойной связи, называются цисизомерами, а если по разные — трансизомерами (от лат. cis — по эту сторону, trans — через, т. е. по разные стороны) (рис. 16).
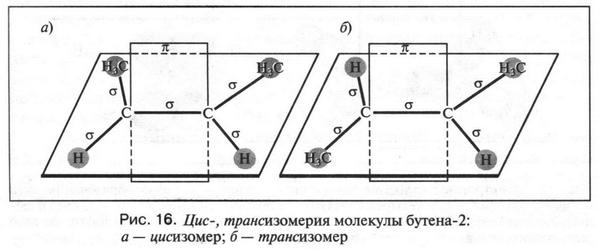
Цис-, трансизомеры, имея различное пространственное строение, отличаются физическими, химическими, а иногда даже — физиологическими свойствами.
Как получают этилен? Обычно его выделяют из газов нефтепереработки, а также из газов коксования угля. Но можно получать этилен и в лаборатории. Еще в 1860 г., исследуя взаимодействие йодистого метилена с галогеноотнимающими средствами, А. М. Бутлеров не только получил этилен, но и сделал вывод о том, что в его молекуле должна быть двойная связь! Эта реакция протекала так:
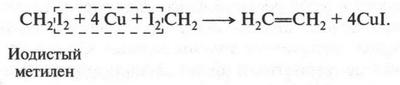
Отщепляя воду от этилового спирта, тоже можно получить этилен. Для этого спирт нагревают с концентрированной серной кислотой:
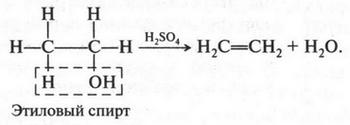
Если же вместо этилового спирта использовать пропиловый спирт, то получим второй представитель алкенов — пропилен (пропен):
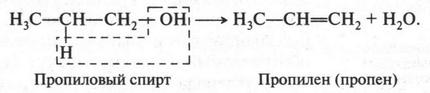
Пропилен во многом напоминает этилен. Он легко вступает в реакции присоединения. При присоединении водорода (в присутствии катализатора) он превращается в пропан, а при воздействии галогенов — в галогенопроизводные:
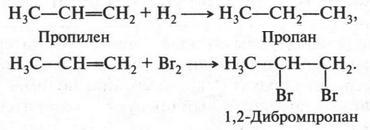
Галогеноводороды также присоединяются к пропилену. Но в отличие от этилена в этом случае может получиться два продукта.
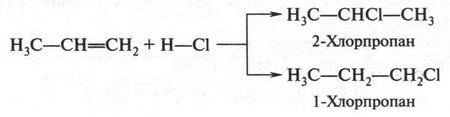
Посмотрите внимательно на их формулы. Нетрудно заметить, что атомы хлора и водорода по-разному присоединились к углеродным атомам. Эту реакцию еще в XIX в. изучал Владимир Владимирович Марковников (1838-1904).

Молекула пропилена, в отличие от молекулы этилена, несимметрична. Поэтому в ней электронная плотность распределена неравномерно. Дело в том, что электронная плотность в молекуле смещена от метильной группы в сторону двойной связи:
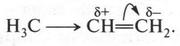
Направление распределения электронов показано стрелками. На крайнем углеродном атоме, который связан двойной связью, образуется небольшой (частичный) отрицательный заряд, обозначаемый ?- (дельта минус). На втором же атоме углерода создается недостаток электронов (возникает частичный положительный заряд ?+). Теперь нетрудно догадаться, что положительно заряженный атом водорода (протон) свяжется с крайним углеродным атомом (он несет избыток электронной плотности), а атом галогена устремится туда, где атом углерода имеет частичный положительный заряд.
Этиленовые углеводороды обладают еще одним интересным свойством. Они вступают в реакцию полимеризации, в результате которой образуется полимерный продукт. Например, при полимеризации этилена химики синтезируют замечательный продукт — полиэтилен:
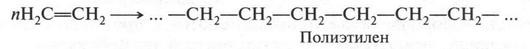
О таких реакциях мы поговорим позже, когда познакомимся с высокомолекулярными соединениями.
Этиленовые углеводороды горят с выделением энергии. Вот как можно записать реакцию горения этилена:
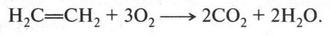
С воздухом этилен, как и метан, образует взрывоопасные смеси.
В заключение скажем, что этилен и его гомологи — источники большого числа разнообразных органических соединений. Например, этилен используют для получения полиэтилена, этилового спирта, галогенопроизводных, оксида этилена и многих других ценных продуктов.
| <<< Назад 3.1. Тетраэдр — «подарок» природы |
Вперед >>> 3.3. Всем известный ацетилен |
