Книга: Удивительный мир органической химии
3.1. Тетраэдр — «подарок» природы
| <<< Назад Глава 3 Молекулы из двух элементов |
Вперед >>> 3.2. Всегда ли двойная связь прочнее? |
3.1. Тетраэдр — «подарок» природы
Вот мы и узнали, как устроен атом углерода — главный элемент органического мира. Теперь перейдем к знакомству с наиболее простыми органическими веществами. Самым известным органическим соединением является метан. Вот формула его молекулы:
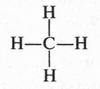
Метан — не только земное, но и космическое вещество: он содержится в атмосфере Сатурна и Юпитера, а в твердом состоянии его обнаружили на Уране и Нептуне. Метан по праву можно назвать «Адамом органического мира». Заменив в его молекуле один или несколько водородных атомов на другие атомы или группы атомов, можно получить многие органические соединения.
Метан — главная составная часть природного (до 98%) газа, а также попутных газов, которые выделяются при добыче нефти. В значительных количествах он присутствует в газах нефтепереработки. Обнаружить метан можно даже в любом болоте или пруду. Если палочкой пошевелить ил, то на поверхность воды поднимутся пузырьки болотного газа, который в основном состоит из метана. Он образовался из погибших растений и других веществ под воздействием особых бактерий без доступа воздуха.
Мы ежедневно встречаемся с метаном. Его используют в качестве дешевого топлива в быту и в промышленности. Метан — газ без цвета и запаха. Поэтому, пользуясь метаном, необходимо быть очень осторожным. Он образует с воздухом взрывоопасную смесь. Обычно для обнаружения утечки метана в газопроводах к нему добавляют небольшое количество сильно пахнущего вещества. Обычно с этой целью применяют газообразные тиоспирты (меркаптаны). Особенно опасен метан в шахтах («рудничный газ»). Взрывы метана в шахтах стоили жизни многим тысячам шахтеров.
Какое строение имеет молекула метана? Ответить на этот вопрос нам поможет теория гибридизации.
Как вы помните, в молекуле метана атом углерода находится в состоянии sp3-гибридизации. Это означает, что атом имеет четыре одинаковые sp3-гибридные орбитали, направленные в пространстве под углом 109°28' друг к другу (рис. 14). Если представить атом углерода центром молекулы, то эти орбитали будут направлены к вершинам правильного тетраэдра. Перекрываясь с четырьмя орбиталями атомов водорода (в атоме водорода единственный электрон занимает шаровую 1s-орбиталь), углеродные орбитали образуют четыре одинаковые связи С—Н. Следует отметить, что перекрывание орбиталей при этом происходит по линии, соединяющей ядра атомов углерода и водорода. Такие химические связи принято называть ?(сигма)-связями, а электроны, образующие их, — ?-электронами.
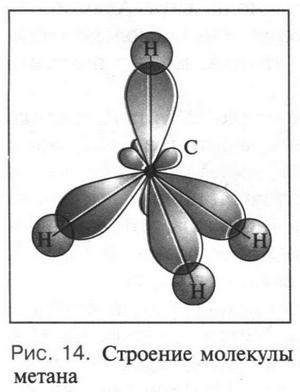
Разве не удивительно, что одна из тайн природы состоит в том, что в качестве основного геометрического элемента для органической химии она избрала тетраэдр!
Мы уже говорили, что химики с успехом используют теорию гибридизации для предсказания пространственной формы многих органических молекул. Например, эта теория довольно точно предсказала величины углов между связями в молекуле метана, а также расположение этих связей в молекуле.
Метан — самое распространенное и доступное химикам вещество. В промышленности его получают из природного газа или нефти. Можно получить метан и в лаборатории, например взаимодействием карбида алюминия с водой:
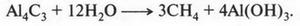
Можно получать метан и при нагревании оксида углерода (II) с водородом в присутствии катализатора:

Однако синтетическим путем метан обычно не получают. В этом нет необходимости, поскольку природный газ состоит практически из метана.
Метан служит прекрасным сырьем для получения многих органических соединений. Мы узнаем об этом, если познакомимся с химическими свойствами этого простого, но удивительного вещества.
Метан относится к органическим соединениям, которые проявляют очень низкую химическую активность. Эти соединения в свое время получили название парафины (от лат. parum affinis — малоактивный). В настоящее время их называют алканами. Метан — самый первый и самый важный представитель класса этих веществ, которые образуют особый ряд, названный гомологическим (от греч. hom?s — равный, одинаковый). Вещества, составляющие этот ряд, являются гомологами. Первым в этом ряду стоит метан. За метаном следует этан, потом — пропан, бутан, пентан и т. д. Все эти вещества подчиняются общей формуле СnН2n+2. Это очень удобная формула. Зная количество атомов углерода в алкане, можно сразу же сказать, сколько в молекуле будет атомов водорода.
Метан и его гомологи (т. е. этан, пропан, бутан, пентан и др.) не взаимодействуют при обычных условиях с кислотами, щелочами, окислителями. Недаром же когда-то эти вещества назвали «химическими мертвецами». И все же химики «приручили» эти соединения. Они заставили их вступать в некоторые реакции. В основном это реакции замещения, при которых происходит замена атомов водорода на другие атомы. Сразу же скажем, что в реакции присоединения (когда к одному веществу присоединяется другое) алканы вступать не могут. И дело тут не в том, что они «капризны». Их углеродные атомы полностью насыщены, т. е. у них нет возможностей присоединять. Действительно, если атом углерода может образовать только четыре связи с другими атомами, то образовать пятую связь он не в состоянии.
Какие же реакции замещения характерны для алканов?
Известно, что при освещении или нагревании метан очень бурно реагирует с хлором. Ученые изучили эту реакцию и выяснили, что она начинается с распада молекулы хлора на два атома хлора. Эти атомы на внешней электронной оболочке имеют один неспаренный электрон. Атомы или группы атомов с таким «лишним» электроном называются свободными радикалами. Распад молекулы хлора при соответствующих условиях на два свободных радикала (два атома хлора) можно изобразить так:

В молекуле хлора точками обозначены электронные пары, а в атоме хлора (справа) показан неспаренный электрон. Такой атом (радикал) обладает высокой энергией. Атакуя молекулу метана, он отрывает от нее водородный атом.
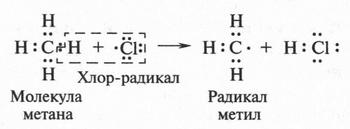
В результате такого отрыва образуется новая активная частица — радикал метил (•СН3). Этот радикал очень быстро (он существует в свободном состоянии тысячные доли секунды) взаимодействует с молекулой хлора, расщепляя ее на две части. В результате образуются молекула хлорметана и снова хлор-радикал:
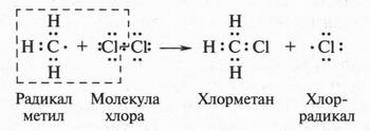
И все повторяется снова: хлор-радикал атакует новые молекулы метана с образованием метильных радикалов, а те, в свою очередь, «набрасываются» на молекулы хлора. Поскольку в результате таких последовательных реакций образуются свободные радикалы, то весь процесс называется свободнорадикальным. Такие реакции называют также цепными, так как одна стадия реакций связана с другой как звенья одной цепи.
Открытие таких реакций было одним из выдающихся событий в химии. За огромный вклад в изучение цепных реакций и создание их теории академик Николай Николаевич Семенов (1896-1986)

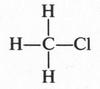
Итак, в результате замещения атома водорода на атом хлора образуется хлорпроизводное метана — хлорметан (или иначе — хлористый метил, газообразное вещество, которое можно применять в холодильных установках в качестве хладагента).
Однако реакция метана с хлором может идти и дальше. Все водородные атомы в молекуле метана можно заместить на атомы хлора. Вот как это выглядит:
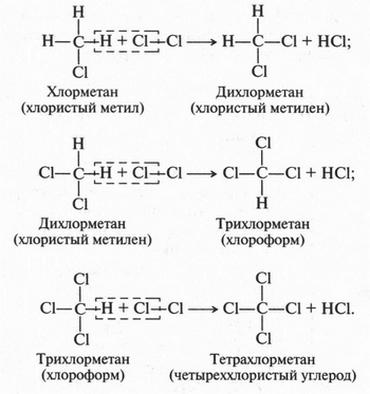
Точно так же с метаном реагирует и бром. Что же касается иода, то при непосредственном взаимодействии его с метаном иодпроизводные получить не удается. А вот фтор с метаном и подобными ему соединениями (алканами) реагирует настолько активно, что эту реакцию можно назвать взрывом. Это происходит потому, что фтор даже при нормальной температуре легко распадается на свободные фтор-радикалы.
Все эти реакции называются реакциями галогенирования, а продукты, получаемые при этих реакциях, носят название галогенопроизводных.
Галогенопроизводные метана (и его гомологов) — химически активные вещества. Из них получают многие органические соединения. Например, если на йодистый метил (иодметан) подействовать металлическим натрием, то получим этан:
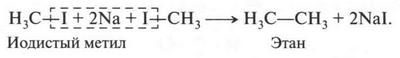
Эту реакцию открыл в 1855 г. французский химик Шарль Адольф Вюрц (1817-1884). С помощью этой реакции можно получать различные предельные углеводороды (алканы).
Кроме реакций галогенирования (хлорирования, бромирования), алканы в особых условиях могут вступать во взаимодействие с кислотами — азотной и серной. Например, при действии разбавленной азотной кислоты (при нагревании и давлении) происходит замещение водородных атомов в алканах на группу NO2 (нитрогруппу):
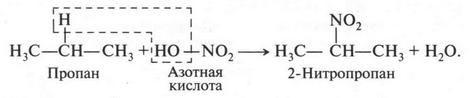
Такие реакции называют реакциями нитрования. Впервые реакцию нитрования провел в 1888 г. Михаил Иванович Коновалов (1858-1906). Поэтому такая реакция носит имя этого русского химика.

Продукты, образованные в результате реакции нитрования, называются нитросоединениями.
Если на алкан действовать смесью оксида серы (IV) и хлора, то получают продукт, который называется сульфохлоридом. Например:
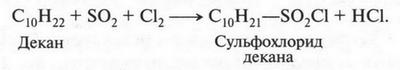
Такие реакции называются реакциями сульфохлорирования. Первую реакцию сульфохлорирования провели в США в 1936 г. Реакции сульфохлорирования приводят к получению очень важных органических продуктов — сульфокислот. Для этого на сульфохлорид нужно подействовать водой. В результате получают два продукта — сульфокислоту и соляную кислоту:
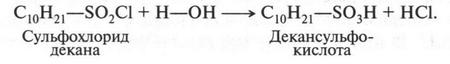
Таким образом, сульфокислота — это продукт замещения атома водорода в алканах на сульфогруппу (—SO3H). Можно ли получать сульфокислоты, непосредственно воздействуя серной кислотой на алканы? Да, иногда это удается, если алканы содержат значительное количество углеродных атомов. Низшие же алканы с серной кислотой при обычных условиях не взаимодействуют, а при нагревании происходит их окисление.
Реакции нитрования и сульфохлорирования имеют также цепной радикальный характер.
Таким образом, из алканов можно получать различные органические вещества. Изучению алканов и их химическим превращениям посвятил свою жизнь известный немецкий химик Карл Шорлеммер (1834-1892). Кстати, он назвал органическую химию химией углеводородов и их производных. А ведь алканы — это углеводороды: их молекулы состоят из атомов углерода и водорода. Таким образом, два определения органической химии — А. М. Бутлерова и К. Шорлеммера — не противоречат, а дополняют друг друга.
Алканы — горючие вещества. При горении метана выделяется большое количество энергии (880 кДж/моль):
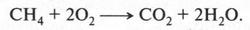
Наряду с метаном в качестве топлива часто используют смесь пропана (С3Н8) и бутана (С4Н10). Эту смесь называют бытовым сжиженным газом. Его перевозят в баллонах (красного цвета) и применяют там, где нет природного газа.
При обычных условиях алканы устойчивы к действию даже сильных окислителей. Но при использовании катализаторов и одновременном нагревании алканы окисляются с образованием многих ценных продуктов (спиртов, карбоновых кислот и др.).
В одном из разделов этой книги мы познакомимся с различными видами топлива, в основе которых — те же самые алканы.
| <<< Назад Глава 3 Молекулы из двух элементов |
Вперед >>> 3.2. Всегда ли двойная связь прочнее? |
