Книга: Биохимия старения
Возрастные изменения в структуре и функциях хроматина
| <<< Назад Модуляция модификаций хромосомных белков |
Вперед >>> Резюме |
Возрастные изменения в структуре и функциях хроматина
Схема потока информации у эукариот выглядит следующим образом: ДНК?РНК?Белок. Скорость образования и количество различных белков, необходимых для осуществления специфических функций, может регулироваться на одном или на нескольких этапах: а) транскрипция гетерогенных ядерных РНК(гяРНК) — предшественников на хроматине; б) процессинг гяРНК-предшественников до зрелых мРНК, способных к трансляции; в) трансляция мРНК на рибосомах и г) разрушение белков различными факторами. Кроме того, количество активных и неактивных белков, способных к активированию, может регулироваться путем непосредственной модуляции активности белков, например их фосфорилированием и аденилированием. Транскрипция, которая является первым и главным этапом в приведенной выше последовательности событий, может модулироваться с помощью изменений в структурной организации хроматина. Эти изменения, по-видимому, могут касаться: а) образования нужной конформации ДНК, б) доступности ДНК для ДНК-полимеразы, в) степени ассоциации гистонов и НГБ с ДНК, г) модификаций гистонов и НГБ, изменяющих их ассоциацию с ДНК.
Изменения транскрипции и, следовательно, активности хроматина происходят во время дифференцировки. Когда активно делящиеся миобластные клетки сливаются, чтобы образовать многоядерную неделящуюся клетку мышцы, изменяется структура синтезируемой РНК и уменьшается ее общее количество [377], а образование рибосомной РНК (рРНК) сильно падает [87]. Это подтверждается тем фактом, что количество РНК, гибридизованной с ДНК после слияния клеток, значительно меньше, чем в делящихся клетках. Процентное содержание РНК с уникальными последовательностями оснований после слияния выше. Это указывает на то, что в дифференцированных клетках экспрессия специфических генов выше, чем других генов, в отличие от делящихся, недифференцированных клеток. Таким образом, во время и после дифференцировки происходят как качественные, так и количественные изменения активности хроматина. По-видимому, имеются контролирующие механизмы, воздействующие как на уникальные, так и на повторяющиеся последовательности ДНК. Клетки сердечной мышцы после рождения перестают делиться, и это сопровождается уменьшением транскрипции. Их ДНК становится менее восприимчивой к ДНКазе I, и температура ее плавления повышается [231].
Описанным выше наблюдениям не противоречат данные, согласно которым слияние миобластов сопровождается сильным увеличением активности креатинфосфокиназы (КФК), что указывает на более интенсивную транскрипцию ее мРНК [257, 259, 317а]. Показано, что активность КФК у цыпленка увеличивается в период дифференцировки в 20 раз, и причиной этому служит увеличение количества ММ-изофермента. Отсюда следует, что транскрибируется преимущественно ген М-субъединицы [235]. Другим важным изменением, происходящим во время дифференцировки сердечной мышцы, является полное прекращение синтеза ДНК-полимеразы [86].
Подобные изменения в транскрипционной активности хроматина происходят на стадии эмбриогенеза у амфибий [102] и морских ежей [118]. Качественные изменения наблюдаются и при индуцированной гормонами дифференцировке молочной железы [355]. Механизм, с помощью которого осуществляется дифференциальная экспрессия генов, неизвестен. Вопрос заключается в том, возникают ли изменения в хроматине — структурные и функциональные — после достижения зрелости и ведут ли эти изменения к старению организма. Для того чтобы найти ответ на эти вопросы, многие исследователи изучали разные свойства хроматина в зависимости от возраста.
В ряде работ измеряли температуру плавления (Tm) хроматина из печени и тимуса, и во всех случаях было обнаружено в старческом возрасте увеличение Tm [31,32, 149,208, 274, 296]. С помощью ЭВМ был изучен профиль температуры плавления хроматина; было обнаружено, что гиперхромизм и Tm в старости увеличиваются [297]. Это может объясняться увеличением с возрастом числа ковалентных связей между хромосомными белками и ДНК [147–150]. Данная точка зрения согласуется с тем, что количество белка, которое можно экстрагировать из хроматина с помощью солевого раствора, с возрастом уменьшается [274], а количество одноцепочечных разрывов в ДНК увеличивается [80], так как включение 3Н-тимидина в ДНК с возрастом увеличивается [143, 294, 311]. Показано, что ДНК печени старой мыши (20 мес) более чувствительна к S1-нуклеазе, чем ДНК мыши в возрасте от 1 до 15 мес [81]. При седиментации ДНК из мозга мыши в градиенте щелочной сахарозы образуются четыре полосы для старых животных и одна для молодых, что свидетельствует о деградации ДНК в старческом возрасте в результате одноцепочечных разрывов. Такие разрывы в ДНК могут обеспечивать центры для ее ковалентного связывания с хромосомными белками. Одним из факторов, который, по-видимому, способствует образованию разрывов, является диметилирование цитозина. Сообщается, что небольшая доля (3- 10 %) цитозина ДНК постсинтетически метилируется с образованием 5-метилцитозина [54, 322]. Эта модификация предохраняет данный сайт ДНК от расщепления ферментом рестрикции [37, 128, 304], в частности ферментом Нра II [240, 323]. В результате деметилирования цитозинов эти сайты могут стать восприимчивыми к расщеплению, что приведет к увеличению числа разрывов в ДНК. Известно, что содержание 5-метилцитозина в печени рыб с возрастом уменьшается [358]. Однако показано, что метилирование ДНК, выделенной из полушарий головного мозга крыс, в старости увеличивается [348]. Это может усиливать связь ДНК с гистонами и не только увеличивать Tm хроматина, но и уменьшать его матричную активность. Стабильны ли метильные группы ДНК — неизвестно, но весьма вероятно, что метилирование ДНК осуществляется ферментами, отличными от тех, которые метилируют гистоны.
Изучение гибридизации ДНК — РНК в печени мышей показало, что доля ДНК, которая гибридизуется с уникальными и повторяющимися последовательностями РНК, с возрастом уменьшается [92]. Как отсюда следует, с возрастом уменьшается доля транскрибируемой ДНК, что в свою очередь указывает на увеличение связывания и маскировки ДНК хромосомными белками. С помощью того же метода измерялось число транскрибированных рибосомных генов на гаплоидный геном мыши [126, 127]. В возрасте более 2 лет наблюдалось резкое уменьшение числа транскрибированных генов. Однако у человека подобные изменения не обнаруживаются. Аналогичные методы использовались для количественной оценки процентного содержания транскрибированной сателлитной ДНК в различных тканях мыши [291]. В селезенке, почках и в мозгу изменений не наблюдалось, но в печени с возрастом ее количество увеличивалось.
Несколько исследователей изучали транскрипцию РНК на хроматине в зависимости от возраста. В экспериментах in vitro с использованием срезов печени и мозга было показано, что синтез РНК в этих тканях в старческом возрасте уменьшается [103, 145]. Причиной этого может являться уменьшение количества РНК-полимеразы [51, 239]. Обнаружено, что транскрипционная активность различных тканей в старости уменьшается [274, 296]. Результаты, полученные в опытах in vivo, свидетельствуют о том, что синтез РНК в печени, мозгу, сердце и селезенке крыс в старческом возрасте понижается [181]. С возрастом претерпевают качественные изменения типы синтезируемых РНК, а отношение РНК: белок уменьшается [92]. РНК некоторых типов, синтезируемые в организме в среднем возрасте, в старости исчезают, и появляются молекулы новых типов, которые не синтезируются в репродуктивном периоде. Это напоминает возрастные изменения в наборе изоферментов, например аланинаминотрансферазы и лактатдегидрогеназы (гл. 3).
Содержание гистонов в клетке каждой ткани остается приблизительно постоянным на протяжении всей жизни [71]. В нуклеосомных гистонах печени и селезенки крыс и мышей количественных и качественных изменений не происходит, но изменяются три субфракции гистона Н1 [248, 249]. Так, в старческом возрасте специфически увеличивается количество субфракции гистона Н1, содержащей метионин. Предстоит выяснить, как это влияет на структуру и функции хроматина. Сообщается, что содержание НГБ и РНК в хроматине крыс с возрастом уменьшается [104, 207].
Хотя гистонов всего несколько и они играют структурную роль, изменения в степени их ассоциации с ДНК могут иметь значение как при транскрипции, так и при репликации. Благодаря различным ковалентным модификациям их ассоциация с ДНК может меняться. Канунго и его сотрудники исследовали in vitro зависимость ковалентных модификаций гистонов от возраста и модуляции этих модификаций различными эндогенными факторами. В опытах использовали срезы коры головного мозга крыс разного возраста. Схема этих исследований показала на рис. 2.5. Было обнаружено, что фосфорилирование гистонов полушарий большого мозга с возрастом уменьшается [182]. В частности, резко уменьшается фосфорилирование гистонов Н1 и Н4. Кальций ингибирует фосфорилирование гистонов, особенно гистонов Н1 и Н4. Этот эффект в старческом возрасте уменьшается (рис. 2.6). Эстрадиол стимулирует фосфорилирование гистонов [183], особенно у взрослых животных, но этот эффект в старости исчезает (рис. 2.7). При уменьшении фосфорилирования гистонов может усиливаться их связь с ДНК благодаря уменьшению числа отрицательных зарядов.
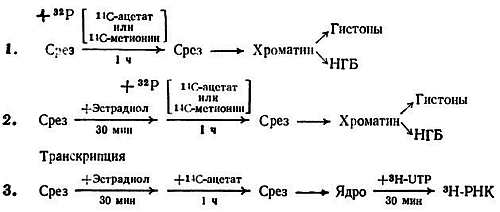
Рис. 2.5. Схема проведения in vitro ковалентных модификаций хромосомных белков и модуляции матричной активности хроматина в срезах коры головного мозга крыс
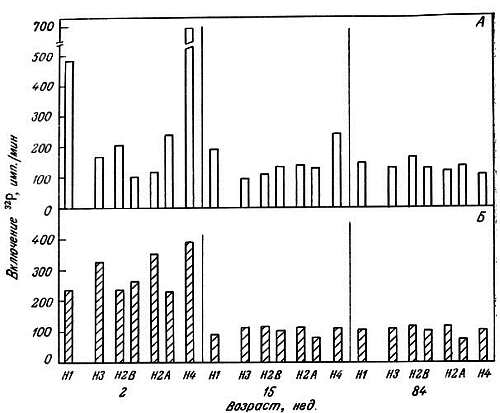
Рис. 2.6. Влияние кальция на включение 32P в гистоны коры головного мозга крыс-самок разного возраста [182].
А. Норма. Б. Добавлен Са2+
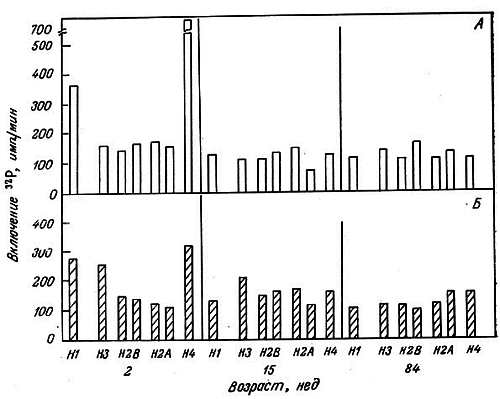
Рис. 2.7. Влияние эстрадиола на включение 32P в гистоны коры головного мозга крыс-самок разного возраста [183].
А. Норма. Б. Добавлен эстрадиол
Ацетилирование гистонов играет роль в транскрипционной активности хроматина. Показано, что ацетилирование гистонов из мозга крыс с возрастом уменьшается [349]. При этом специфическое уменьшение наблюдается для гистонов Н3 и Н4, а ацетилирование гистона Н1 не меняется. Адреналин стимулирует ацетилирование гистона Н1, а эстрадиол — гистона Н3. Эти модулирующие эффекты в старческом возрасте уменьшаются. Кальций не оказывает значительного влияния на ацетилирование гистонов (рис. 2.8).
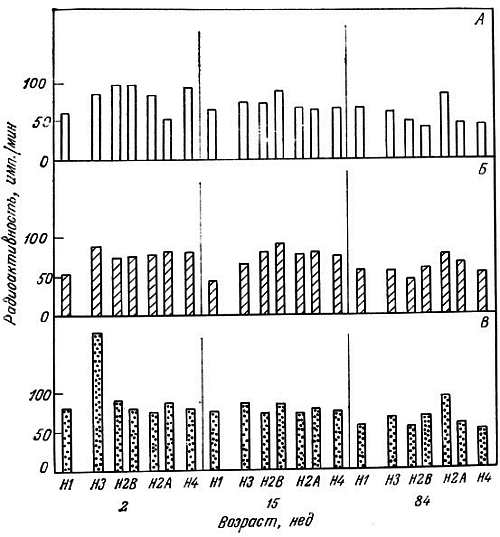
Рис. 2.8. Влияние кальция и эстрадиола на ацетилирование отдельных гистонов коры головного мозга крыс-самок разного возраста [348, 349].
А. Норма. Б. Добавлен Са2+. В. Добавлен эстрадиол
Было изучено влияние ацетилирования гистонов и его модуляций, вызываемых бутиратом и эстрадиолом, на функции хроматина из коры головного мозга крыс [184]. Как бутират, так и эстрадиол, добавленные в инкубационную среду, содержащую 14С-ацетат и срезы головного мозга, стимулировали ацетилирование гистонов у молодых крыс. Этот эффект сильно уменьшался у взрослых особей и вообще не наблюдался у старых животных (110 нед). Если из этих срезов выделяли ядра и использовали их для транскрипции при инкубировании с 3H-UTP и другими нуклеотидтрифосфатами, то наибольшее стимулирование транскрипции наблюдалось у молодых крыс, а у взрослых этот эффект сильно уменьшался. Изучаемые модуляторы ее оказывают никакого влияния на транскрипцию у старых крыс (рис. 2.9). Полученные данные указывают не только на корреляцию между ацетилированием гистонов и транскрипцией хроматина, но и на уменьшение в старческом возрасте модулирующего влияния бутирата и эстрадиола. Это может быть обусловлено структурными и конформационными изменениями хроматина, появляющимися при увеличении возраста.
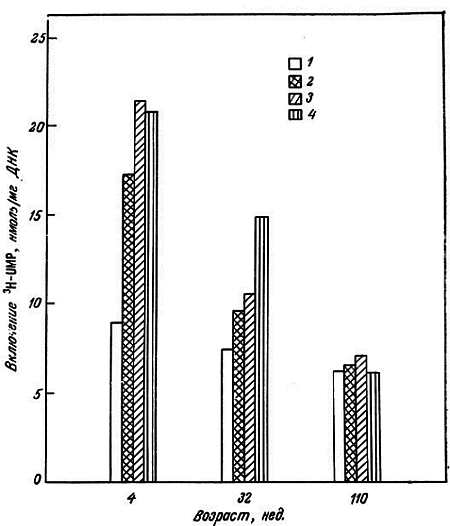
Рис. 2.9. Включение 3H-UMP в РНК из ацетилированных ядер коры головного мозга крыс-самок разного возраста и действие масляной кислоты и эстрадиола [184].
1 — срез; 2 — срез после ацетилирования; 3 — срез после ацетилирования + масляная кислота; 4 — срез после ацетилирования + эстрадиол
Изучение метилирования гистонов из мозга крыс показало, что эта модификация с возрастом также замедляется, особенно в случае гистонов Н3 и Н4 (рис. 2.10) [348]. Однако метилирование является стабильной модификацией, и поэтому несмотря на то, что с возрастом происходит замедление включения групп 14СН3, общее число метальных групп в гистонах увеличивается, так как те группы, которые были введены в более раннем возрасте, уже не удаляются. При метилировании гистонов, особенно при образовании триметиллизиновых остатков гистона Н3, их связь с ДНК усиливается. Эстрадиол стимулирует метилирование гистона Н2В, а кальций — гистона Н3. Эти модуляционные эффекты в старческом возрасте отсутствуют. Ковалентные модификации определенных гистонов специфическими эффекторами, несомненно, меняют не только структуру, но и функции хроматина.
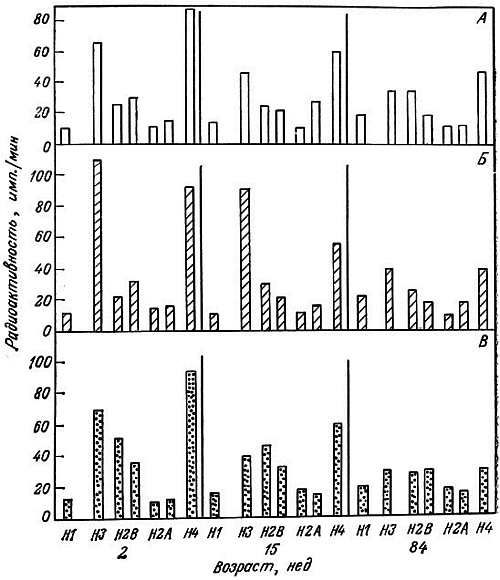
Рис. 2.10. Влияние кальция и эстрадиола на метилирование отдельных гистонов коры головного мозга крыс-самок разного возраста [348].
А. Норма. Б. Добавлен Са2+. В. Добавлен эстрадиол
Содержание НГБ с возрастом уменьшается [208, 384]. Метаболически активные ткани содержат больше этих белков, чем неактивные. По-видимому, с уменьшением их количества активность тканей снижается. Электрофорезом НГБ мозга в полиакриламидном геле были показаны не только качественные, но и количественные возрастные изменения во фракциях НГБ [185]. Ковалентные модификации НГБ и их модуляция различными эндогенными эффекторами также зависят от возраста [182, 183, 185, 349]. Показано, что фосфорилирование, ацетилирование и метилирование НГБ мозга в старости очень сильно замедляются. Кальций стимулирует их фосфорилирование как в среднем, так и в старческом возрасте. Однако стимулирующий эффект эстрадиола, наблюдающийся в среднем возрасте, в старости не проявляется (рис. 2.11, 2.12). Кальций не стимулирует ацетилирование НГБ, а эстрадиол и адреналин стимулируют его у молодых крыс, но не оказывают влияния в случае крыс среднего возраста и старых крыс (рис. 2.13). Ни кальций, ни эстрадиол не влияют на метилирование НГБ. Показано, что эти эффекторы модулируют модификацию специфических НГБ [185]. Вероятно, фосфорилирование НГБ более важно для экспрессии генов, чем их ацетилирование и метилирование. Как позволяют предположить эти данные, замедление ковалентных модификаций НГБ в старческом возрасте может происходить из-за того, что соответствующие центры становятся малодоступными. Это в свою очередь может быть обусловлена конформационными изменениями в хроматине вследствие более сильного связывания НГБ с ДНК.
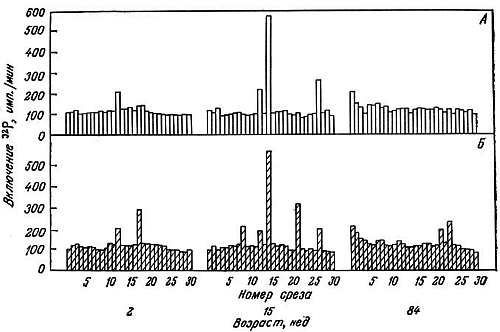
Рис. 2.11. Влияние кальция на фосфорилирование отдельных НГБ коры головного мозга крыс-самок разного возраста [185].
А. Норма. Б. Добавлен Са2+
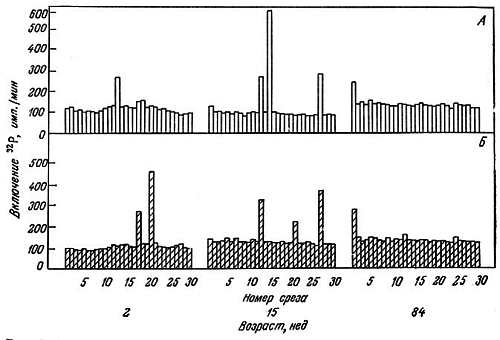
Рис. 2.12. Влияние эстрадиола на фосфорилирование отдельных НГБ белков коры головного мозга крыс-самок разного возраста [185].
А. Норма. Б. Добавлен эстрадиол
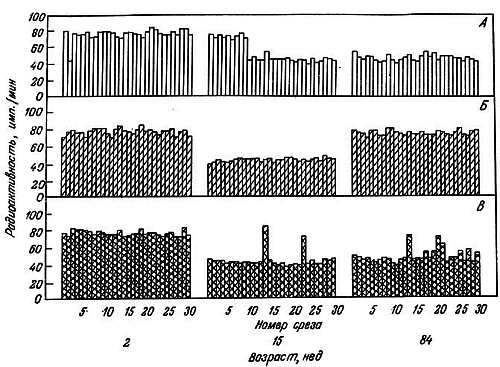
Рис. 2.13. Влияние кальция и эстрадиола на ацетилирование отдельных НГБ коры головного мозга крыс-самок разного возраста [185].
А. Норма. Б. Добавлен Са2+. В. Добавлен эстрадиол
Функции хроматина самым тесным образом связаны с его структурной организацией, и если структура меняется, то, несомненно, меняются и функции. К функциям хроматина относятся репликация и транскрипция. Показано, что у свободноживущей нематоды Turbatrix aceti, клетки которой не делятся, активность ДНК-полимеразы с возрастом уменьшается [45].
Есть сообщение, что синтез ДНК в постмитотических тканях — в мозгу, сердце и печени — у старых крыс усиливается [294]. Клетки этих тканей не вступают в митоз. Поэтому предполагают, что синтез ДНК в них происходит только в целях репарации ДНК, которая в старческом возрасте в большей степени подвергается расщеплению [80, 81]. В клетках слюнной железы крыс синтез ДНК индуцируется изопротеренолом (изадрином), но лагпериод индукции с возрастом увеличивается, а степень индукции уменьшается [4].
Исследования, выполненные in vitro на клетках фибробластов в культуре, показали, что с уменьшением способности клеток к делению и с увеличением продолжительности клеточного цикла в поздних пассажах (фаза III) активность ДНК-полимеразы уменьшается [360]. Кроме того, в таких клетках наблюдается уменьшение количества репараций ДНК [233].
| <<< Назад Модуляция модификаций хромосомных белков |
Вперед >>> Резюме |
- Изменения регуляции генов
- 9.4.1. Циклические изменения
- Изменения активности генов
- Изменения белков
- Древние изменения большого материка восточного полушария
- Географическое распространение животных и изменения земной поверхности, на которые оно указывает
- Изменения белок-кодирующих генов
- Прежние взгляды на изменения материков
- 7.3. Разнообразие экосистем (биогеоценозов). Саморазвитие и смена экосистем. Выявление причин устойчивости и смены экоси...
- 2. Белки хроматина
- 658. Как реагируют рыбы на сезонные изменения температуры?
- 698. Как влияют изменения температуры на промысел сардины?
