Книга: Биохимия старения
Модификации хромосомных белков
| <<< Назад Негистоновые хромосомные белки |
Вперед >>> Модуляция модификаций хромосомных белков |
Модификации хромосомных белков
Посттрансляционная ковалентная модификация происходит в боковых группах аминокислотных остатков нескольких белков [357]. Хромосомные белки — как гистоны, так и НГБ — синтезируются в цитоплазме и затем переходят в ядро, где они связываются с ДНК. Эти белки, особенно гистоны, подвергаются разнообразным посттрансляционным ковалентным модификациям: фосфорилированию, ацетилированию, метилированию и ADPрибозилированию. Ацетилирование NH2-концевого серинового остатка гистонов Н1, H2A и Н4 происходит во время трансляции и представляет собой стабильную модификацию [229]. Ацетилирование внутренних лизиновых остатков гистонов Н3 и Н4 и фосфорилирование внутренних сериновых остатков происходит в цитоплазме. Затем эти гистоны переходят в ядра и связываются с ДНК [308]. Ацетилирование внутренних лизинов обратимо. Кроме того, обратимая модификация лизиновых остатков происходит уже после связывания гистонов с ДНК. Путем ковалентных модификаций четырех типов изменяются ионный состав гистонов и их стерические свойства, а следовательно, и взаимодействие с ДНК (рис. 2.4).
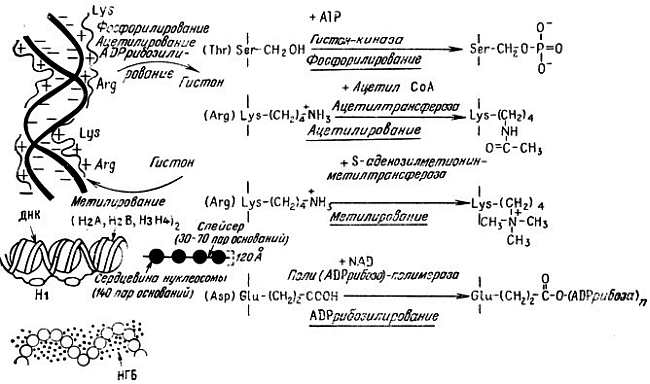
Рис. 2.4. Структура хроматина с указанием центров связывания гистонов и НГБ с ДНК. Представлены ковалентные модификации гистонов, в результате которых изменяется их связывание с ДНК
При таких модификациях, как фосфорилирование и ADPрибозилирование, число отрицательных зарядов на гистонах увеличивается, и это может привести к их отделению от ДНК, в результате чего становится возможной ее транскрипция или репликация. При ацетилировании общий положительный заряд на гистонах уменьшается. Это также может приводить к их отделению от ДНК. Вместе с тем при метилировании положительный заряд на молекулах гистонов может увеличиваться, что приводит к более сильному связыванию их с ДНК и, как следствие, к подавлению активности генов. Специфические аминокислоты подвержены специфическим модификациям. Определенные модификации преимущественно происходят в определенных гистонах и к тому же на специфических фазах клеточного цикла и роста клетки. Таким образом, не исключено, что модификации боковых групп хромосомных белков являются механизмом тонкой регуляции экспрессии генов. В табл. 2.3 приведены некоторые характеристики этих модификаций.
Таблица 2.3.Параметры ковалентных модификаций цепей гистонов

Фосфорилирование
Фосфорилирование хромосомных белков представляет собой энергозависимую постсинтетическую модификацию. Оно происходит как в цитоплазме, так и в ядре [273, 276, 308]. Орд и Стокен [275] продемонстрировали включение в гистоны 32P in vivo. Позднее было показано, что гистон Н1 фосфорилируется в большей степени, чем другие гистоны [23]. Главными центрами фосфорилирования с помощью специфических с АМР-зависимых протеинкиназ являются боковые группы сериновых и треониновых остатков гистонов и НГБ. Лизиновые, гистидиновые и аргининовые остатки фосфорилируются в малой степени. Киназы присутствуют во фракции НГБ хроматина. В фосфорилировании специфических центров, по-видимому, участвуют специфические гистоновые киназы. Из хроматина тимуса быка удалось выделить АМР-зависимую киназу, которая фосфорилирует единственный центр в гистоне Н3 [321]. Дефосфорилирование этих остатков производится фосфатазами, которые также присутствуют во фракции НГБ. Надежно установлено, что фосфорилирование и дефосфорилирование ферментов являются одним из основных механизмов регулирования их активности, поскольку эти модификации, вызывая конформационные изменения, переводят ферменты из активного состояния в неактивное, и наоборот [137]. При подобных модификациях в молекулах хромосомных белков происходят структурные изменения, которые могут приводить к функциональным изменениям хроматина. Реакция фосфорилирования — дефосфорилирования гистона показана ниже:
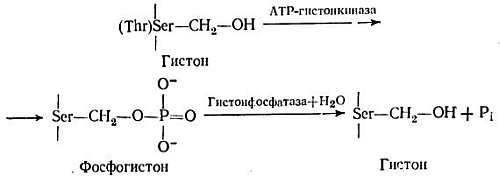
В молекулах хромосомных белков обнаружены два типа присоединения фосфатных групп [79]. Один из них, включающий связь Р-О, характерен для сериновых и треониновых остатков, причем эта связь устойчива по отношению к кислоте. Второй тип включает связь P-N, которая образуется в лизиновых, гистидиновых и аргининовых остатках. Эта связь неустойчива в кислых средах.
Фосфорилирование гистонов
Процесс фосфорилирования — дефосфорилирования внутренних остатков хромосомных белков совершается с большой скоростью. Быстрое фосфорилирование наблюдается не только в делящихся, но и в неделящихся клетках после их стимуляции различными эффекторами. В основном фосфорилированию подвержен гистон Н1, т. е. фосфорилирование гистонов, по-видимому, не влияет на транскрипционную активность хроматина.
Центры фосфорилирования гистона Н1 различны на разных стадиях клеточного цикла. Ser-37 фосфорилируется в фазе G1, Ser-114 в фазах S и G2, Ser-180 — в фазе М [206]. По-видимому, это объясняется множественностью Н1-киназ, каждая из которых специфична. Было показано, что быстрорастущие клетки содержат специфичную гистон-киназу, которая катализирует фосфорилирование треониновых остатков, но не Ser-37 и Ser-105 [216]. При фосфорилировании одного из остатков Ser-37 и Ser-105 или обоих степень связывания гистона Н1 с ДНК значительно уменьшается [299]. Такие различия в свойствах разных центров фосфорилирования могут объяснять функциональную роль гистона Н1 в конденсации хроматина. При фосфорилировании различных центров хроматин деконденсируется различным образом, благодаря чему открываются разные участки ДНК.
Показано, что фосфорилирование гистонов связано с изменениями в структуре хроматина особенно во время митоза [140, 143, 144]. Высокая скорость фосфорилирования наблюдается во время митоза клеток яичника китайского хомячка. Такие же модификации наблюдаются в клетках HeLa [209, 210]. Центры фосфорилирования гистона Н1 при митозе (Him) отличаются от центров во время интерфазы (НИ) [25, 162., 209]. Было выдвинуто предположение, что фосфорилирование гистона Н1 необходимо для конденсации интерфазного хроматина в хромосомы. Это совпадает с данными, согласно которым трижды фосфорилированный гистон Н1 связывается с ДНК сильнее, чем дефосфорилированный [196]. У слизистого гриба Prysarum polycephalum фосфорилирование гистона Н1 увеличивается в середине фазы G2 и резко нарастает вплоть до профазы [253]. Дефосфорилирование происходит в последней стадии митоза.
Фосфорилирование различных центров наблюдается также у гистона Н3, но оно не обнаружено у гистонов Н2А, Н2В и Н4. В детальных исследованиях фосфорилирования гистонов Н1 и Н3 из яичника китайского хомячка в процессе митоза было показано, что у большинства клеток эукариот 2–4 центра в гистоне Н1 фосфорилируются в фазе S и дополнительные центры во время митоза (М) [25]. Центры фосфорилирования в фазах S и М, по-видимому, независимы. Более того, эти центры отличаются от тех, которые участвуют в ответе на действие гормона [216]. На ранних стадиях препрофазы, когда начинается агрегация хроматина, гистон Н1 имеет 1–3 фосфатные группы на молекулу, а гистон Н3 не фосфорилируется [95, 140]. Во время промета- и анафазы, когда хроматин агрегирует, все молекулы гистона Н1, а также Н3 суперфосфорилируются и имеют 3–6 фосфатных групп на молекулу. Это может быть обусловлено 6-10-кратным увеличением в митотических клетках содержания специфической АТР-гистон-фосфотрансферазы [209, 210]. Благодаря суперфосфорилированию фибриллы хроматина способны скручиваться в сверхспирали. В телофазе, когда хроматин дезагрегирует, оба гистона, Н1 и Н3, дефосфорилируются. Когда клетки вступают в фазу G1, гистон Н1 полностью дефосфорилируется. Таким образом, суперфосфорилирование гистона Н1m и фосфорилирование гистона Н3 являются митотическими событиями, которые происходят только тогда, когда хромосомы полностью конденсированы. Следовательно, для конденсации хроматина во время митоза необходима высокая степень фосфорилирования гистонов Н1 и Н3, тогда как дефосфорилирование ограничивает этот процесс в интерфазе. Удивляет, однако, тот факт, что при высокой степени фосфорилирования, когда, казалось бы, должна была происходить диссоциация комплекса гистонов Н1 и Н3 с ДНК из-за увеличения отрицательных зарядов на них, наблюдается увеличение конденсации. Для того чтобы выяснить фундаментальный механизм, с помощью которого происходят конденсация и деконденсация хромосом, необходимы дальнейшие исследования. В печени крысы в период развития фосфорилирование гистона Н1 значительно, но оно пренебрежимо мало в печени взрослых животных [22]. Однако фосфорилирование усиливается, когда клетки печени делятся после частичной гепатэктомии [24]. Показано, что в этих условиях отношение числа связей P-O к P-N в печени меняется [79]. P-N-связи обнаруживаются главным образом в гистонах Н1 и Н4. Содержание Hl-киназы на протяжении клеточного цикла не меняется, но количество Н4-киназы увеличивается во время синтеза ДНК. Гистон Н4 также максимально фосфорилируется в фазе S, примем центрами атаки являются гистидиновые остатки. Таким образом, в результате фосфорилирования гистон Н4 может отделяться от ДНК, что способствует ее репликации. Отсюда можно, по-видимому, заключить, что фосфорилирование гистонов необходимо для репликации ДНК, за которой следует деление клетки [26, 161]. Показано, что транскрипция изолированных нуклеосом печени крысы после фосфорилирования усиливается [278]. Фосфорилированный и нефосфорилированный гистоны Н1 отличаются друг от друга по способности подавлять матричную активность хроматина [365]. С помощью метода кругового дихроизма было обнаружено, что фосфорилированные гистоны обладают измененной конформацией [6]. Этим может объясняться тот факт, что модифицированные гистоны вызывают дерепрессию хроматина.
Гистон Н5 также подвержен фосфорилированию. В эритроцитах птиц гистон Н5 фосфорилируется вскоре после его синтеза и затем дефосфорилируется по мере созревания клетки [335]. В отличие от других гистонов гистон Н5 дефосфорилируется в период инактивации генома и конденсации хромосом. Фосфорилированный гистон Н5 не так эффективно вызывает изменение конформации ДНК, как его дефосфорилированная форма. Фосфорилированные остатки (серии) обнаруживаются в областях гистона Н5, имеющих сильноосновный характер и связанных с ДНК. 50 % фосфатов находится в области 1-28, а остальные — на участке 100–200. В процессе сперматогенеза у некоторых видов млекопитающих протамины претерпевают фосфорилирование — дефосфорилирование, что, по-видимому, необходимо для упаковки ДНК [242].
Фосфорилирование НГБ
НГБ фосфорилированы в высокой степени и содержат как P-O-, так и P-N-связи. Полагают, что их фофорилирование катализируют киназы, отличные от тех, которые катализируют фосфорилирование гистонов. Существенным для фосфорилирования является содержание протеинкиназ и сАМР [180]. Кальцитонин стимулирует фосфорилирование НГБ костных клеток в культуре, особенно белков с малой молекулярной массой (10000-45000), но подавляет фосфорилирование НГБ с большой молекулярной массой. Вместе с тем гормон паращитовидной железы стимулирует фосфорилирование НГБ с большой молекулярной массой. Таким образом, два пептидных гормона, противоположным образом влияющие на метаболизм кальция, могут реализовать свое действие с помощью фосфорилированных НГБ. Стероидные гормоны также индуцируют фосфорилирование НГБ [88, 183].
Фосфорилирование НГБ зависит от типа клеток и их физиологического состояния [191]. Скорость этого процесса в синхронизированных клетках HeLa in vitro меняется, причем самая большая скорость наблюдается в фазах G1 и S. Когда покоящиеся клетки LC начинают быстро размножаться, одним из самых ранних событий является фосфорилирование НГБ. При добавлении к ядрам клеток печени крыс полиаминов, спермина и спермидина активность протеинкиназы ядер повышается в 2–3 раза, а скорость фосфорилирования НГБ — во много раз [115]. У Physarlum полиамины стимулируют фосфорилирование нескольких уникальных НГБ [19].
В отличие от фосфорилированных гистонов, которые влияют на структуру хроматина, фосфорилированные НГБ участвуют в экспрессии генов [284, 306, 332, 351]. Фосфорилированные НГБ клеток HeLa в фазе G1 стимулируют транскрипцию генов гистона в фазе G1, хотя в данной фазе эти гены не активны. Фосфорилированные НГБ усиливают транскрипцию, а дефосфорилированные уменьшают ее [85, 270]. Механизм этого воздействия, вероятно, заключается в непосредственном взаимодействии белков с ДНК. Такой вывод вытекает из следующих наблюдений: НГБ обладают различной способностью к фосфорилированию, способ их фосфорилирования зависит от типа ткани; при изменениях в их фосфорилировании изменяются структура хроматина и активность генов, а фосфорилированные НГБ специфически связываются с ДНК. НГБ клеток карциномы молочной железы в стадии зависимого от гормона роста и во время регрессии фосфорилируются по-разному [83]. Когда хроматин фибробластов W1-38 человека реконструируют из ДНК и нефосфорилированных или фосфорилированных НГБ, в последнем случае степень транскрипции много больше [295].
Ацетилирование
Есть сообщение о наличии у гистонов ацетильных групп [288]. Ацетилирование гистонов в изолированных ядрах впервые было описано Олфри с сотрудниками [13]. В гистонах обнаружены ацетилированные аминокислотные остатки двух типов: а) NH2-концевой серии гистонов Н1, Н2А и Н4 ацетилируется в N-ацетилсерин; это необратимая постсинтетическая модификация, катализируемая ферментом, содержащимся в цитозоле; б) ацетилированные внутренние лизиновые остатки образуются в результате постсинтетической реакции, протекающей в цитозоле [308] и в ядре после того, как гистоны переходят из цитозоля в ядро и связываются с ДНК [65]. Ацетилирование внутренних остатков в гистоне Н1 либо незначительно, либо вообще отсутствует. Ацетилируется один центр в гистоне Н2А и по четыре центра в каждом из гистонов Н2В, Н3 и Н4. Ацетилирование лизиновых остатков катализируется ацетилтрансферазой, являющейся компонентом НГБ. ?-NH2-группы внутренних лизиновых остатков, расположенных на NH2-концах половины гистонов, ацетилируются с образованием ?-N-ацетиллизина [11, 101, 130], причем в одной молекуле может содержаться до четырех ацетильных групп. Это энергозависимая реакция, в которой источником ацетильной группы является ацетил-CoA. Деацетилирование катализируется деацетилазой, которая также присутствует в хроматине. Схема реакции приведена ниже:
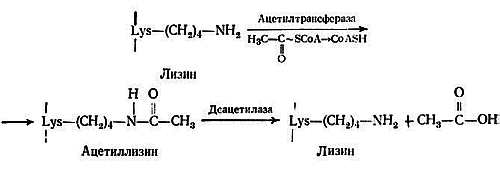
Ацетилируются внутренние лизиновые остатки 9, 14, 18 и 23 гистона Н3 и 5, 8, 12 и 16 гистона Н4 [67, 99]. Эти остатки расположены в NH2-концевой области полипептидной цепи, которая является сильно основной и взаимодействует с кислотными группами ДНК. Ацетилированные гистоны связываются с ДНК менее эффективно, чем деацетилированные [6]. Ацетилирование внутренних лизиновых остатков — процесс обратимый и происходит весьма быстро при самых разных условиях. Период полупревращения реакции ацетилирования очень мал и составляет всего около 3 мин [172, 267]. Были изолированы две гистон-ацетилтрансферазы, имеющие различные оптимумы рН. Ацетилирование ингибируется ионами Mn2+. Этот факт представляется важным, поскольку двухвалентные катионы необходимы для функционирования ДНК-зависимой РНК-полимеразы. сАМР, влияющая на фосфорилирование, не действует на ацетилирование [33]. Максимальная скорость ацетилирования достигается в интерфазе, по мере вхождения клеток в митоз она уменьшается. Минимальная скорость реакции наблюдается в профазе и метафазе, когда хромосомы в наибольшей степени конденсированы [95]. По мере того как клетки входят в телофазу и хромосомы увеличиваются в размере, скорость ацетилирования гистона Н4 увеличивается. Минимальный синтез РНК наблюдается в профазе и метафазе, когда хромосомы сильно конденсированы. Важно, что ацетилирование гистона Н4 также минимально именно в этих двух фазах клеточного цикла [33]. Ацетилирование гистонов Н3 и Н4 в эритробластах птиц уменьшается по мере их превращения в зрелые эритроциты, в которых хроматин сильно конденсирован и неактивен ни в транскрипции, ни в репликации [309]. Таким образом, деацетилирование гистонов коррелирует с ингибированием транскрипции, и наоборот, ацетилирование стимулирует транскрипцию. Так как при ацетилировании нуклеосомных гистонов уменьшается их положительный заряд, они могут отделяться от ДНК, благодаря чему ДНК делается доступной для транскрипции.
Если хроматин депротеинизируется, то его транскрипция усиливается [167]. Показано, что при стимуляции синтеза РНК в лимфоцитах митогенами [289], в тканях-мишенях — гормонами [228] и в печени — после частичной гепатэктомии [290] сначала происходит ацетилирование гистонов. В результате ацетилирования нуклеосомных гистонов усиливается транскрипция хроматина тимуса теленка [241]. Если гистоны Н2А и Н2В добавить к ДНК, лишенной хроматина, то транскрипция подавляется. Однако если эти два гистона затем ацетилируются, то репрессия прекращается. При ацетилировании гистонов Н3 и Н4 также наблюдается стимуляция транскрипции. Показано, что ацетилирование предшествует увеличению синтеза РНК [308]. Ацетилирование гистонов происходит не только в делящихся, но и в неделящихся клетках, в которых значительная часть хроматина неактивна в отношении транскрипции [66]. Ацетилирование гистонов стимулирует удлинение цепей при транскрипции [241]. Возможно, что транскрипция генов, которые специфически "включаются" эффекторами, контролируется степенью ацетилирования гистонов и (или) НГБ.
Приведенные выше заключения подтверждаются следующими фактами. Транскрипционно неактивный гетерохроматин инфузорий имеет низкую степень ацетилирования, тогда как эухроматин транскрипционно активен и сильно ацетилирован [232]. Транскрипционно активные макроядра Tetrahymena pyriformis содержат ацетилированные гистоны, тогда как в репрессированных микроядрах их нет [136]. Активные материнские хромосомы червеца содержат значительно больше ацетильных групп, чем неактивные отцовские хромосомы [34]. В исследованиях, выполненных на клетках Drosophila в культуре [227], показано, что 14С-ацетат включается главным образом в гистоны Н3, Н4 и Н2В, а 32Р-фосфат — в гистоны Н1, Н3 и Н4. Самое высокое содержание как 14С-ацетата, так и 32Р наблюдается в гистоне Н3. Когда матрично активные и матрично неактивные области хроматина разделяли после его переваривания ДНКазой II, было обнаружено, что первые содержат большее количество обеих меток (14С и 32Р). Эти данные подтверждают предположение, что различия между транскрибируемыми и нетранскрибируемыми областями хроматина отчасти объясняются специфическими модификациями гистонов в определенных локусах.
Степень ацетилирования гистонов из клеток семенника форели изучали путем инкубирования их с 14С-ацетатом [96]. Гистоны Н2А, Н2В и Н3 ацетилируются в одном положении, в то время как гистон Н4 — в одном, двух, трех и четырех положениях. Когда нуклеосомы, полученные после ацетилирования, обрабатывали трипсином, при этом удаляли NH2-концевые области четырех гистонов, содержащие лизиновые остатки и связанные с ДНК. Эти лизиновые остатки как раз и были ацетилированы. Если нуклеосомы затем расщепляли нуклеазой, то освобождались фрагменты ДНК, обычно при наличии NH2-концевых областей устойчивые к нуклеазе [368]. Ацетилирование приводит к увеличению скорости расщепления хроматина ДНКазой I [268, 362]. Хроматин, содержащий высокоацетилированные гистоны, легче расщепляется ДНКазой I, но не микрококковой нуклеазой [244]. Когда хроматин из семенника форели гидролизовали ДНКазой II, получали транскрипционно активную фракцию, содержащую высокоацетилированный гистон Н4 [97]. Гистоны Н3 и Н4 клеток HeLa сильно ацетилируются при выращивании в бутирате. Нуклеосомная ДНК таких клеток гидролизуется ДНКазой I в 5-10 раз быстрее. При этом ДНК специфически расщепляется в сайте, где в нормальных условиях разрыва не происходит [324]. Показано также [268, 315, 316], что ДНКаза I предпочтительно расщепляет ДНК в тех областях хроматина, которые сильно ацетилированы. По-видимому, нуклеосомы в этих областях после ацетилирования подвергаются конформационным изменениям. Поскольку такие изменения необходимы для того, чтобы РНК- и ДНК-полимеразы могли использовать ДНК в качестве матрицы, не исключено, что ацетилирование представляет собой один из. способов, с помощью которого гистоны частично отделяются от ДНК, благодаря чему последняя становится доступной для ферментов. Таким образом, ацетилирование важно как для функционирования хроматина, так и для его структуры и конформации. Высказано предположение, что гистон Н4 связывается с ДНК по механизму, на первых стадиях которого происходит ацетилирование [236]. Затем может произойти деацетилирование, приводящее к электростатическим взаимодействиям, в результате которых закрепляется конформация. В сперматиде морского ежа, не синтезирующей РНК, гистон Н4 полностью деацетилирован, тогда как в эмбрионе, где наблюдается высокая активность генов, он ацетилирован [53]. Таким образом, между ацетилированием гистона Н4 и активностью хроматина наблюдается прямая корреляция.
Изучению роли ацетилирования гистонов в функционировании хроматина способствовало обнаружение того факта, что в присутствии бутирата эта модификация усиливается и гистоны Н3 и Н4 специфически гиперацетилируются [68, 302, 315], так как бутират ингибирует гистон-деацетилазу. Бутират ингибирует предпочтительно эндогенную деацетилазу гистонов Н3 и Н4 [287], и при этом он не влияет на скорость ацетилирования [41, 68, 300]. По-видимому, гистон-деацетилаза может играть важную роль в метаболическом контроле ацетилирования. При гиперацетилировании гистонов связанная с ними ДНК в клетках HeLa становится более доступной для ДНКазы I, но не для стафилококковой нуклеазы. ДНКаза I способствует также удалению из комплекса гистонов Н3 и Н4 [359]. Одновременно подавляется синтез ДНК [146]. Можно предположить, что ацетилирование гистонов специфически необходимо для транскрипции и не нужно для репликации. В отличие от фосфорилирования, которое характерно для гистона Н1 и только делящихся клеток, ацеталирование протекает главным образом в гистонах Н3 и Н4 и в делящихся, а также неделящихся клетках, которые метаболически активны. Это подтверждает предположение, согласно которому ацетилирование нуклеосомных гистонов играет важную роль в транскрипции. Об ацетилировании НГБ известно очень мало; в одной из работ сообщается, что ацетилируются белки HMG из ядер тимуса теленка и эритроцитов утки [333].
Метилирование
Метилирование гистонов является постсинтетической необратимой модификацией, которая катализируется гистон-метилтрансферазой III, присутствующей во фракции НГБ хроматина. Эта модификация была впервые обнаружена Олфри и сотрудниками [13]. Гистон-метилтрансфераза III катализирует переход СН3-группы из S-аденозилметионина в ?-NH2-группу лизинового остатка, как показано ниже:
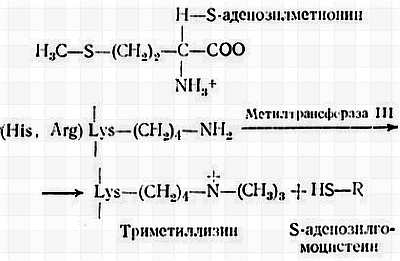
Эта модификация гистонов происходит после их связывания с ДНК. Метальные группы гистонов в отличие от фосфорильных и ацетильных групп не вступают в дальнейшие реакции [62, 63]. Вследствие этого метилирование является стабильным процессом. Цитоплазматический фермент — метилаза I метилирует аргинин прежде, чем гистон проникает в ядро [363]. НГБ метилируются особым ферментом. С атомом ?-N-лизинового остатка могут быть связаны одна, две или три метальные группы, которые последовательно вводятся одним и тем же ферментом. Поэтому метиллизиновые остатки могут представлять собой моно-, ди- или триметиллизин. В основном метилируются гистоны Н3 и Н4. В гистоне Н3 соотношение моно-, ди- и триметиллизинов составляет 1,8:1,0:0,45. В гистоне Н4 отношение моно- к диметиллизину равно 0,7:1,0. Таким образом, гистон Н3 метилирован в большей степени, чем гистон Н4. Очищенные гистоны в противоположность гистонам, связанным с хроматином, являются неподходящими субстратами для метилирования. Метилированные гистоны Н3 и Н4 после выделения могут метилироваться и дальше по центрам, отличным от тех, по которым идет реакция для гистонов, связанных с хроматином. Очевидно, эти дополнительные центры недоступны для метилирования из-за специфической конформации в хроматине. Метиллизины расположены вблизи ацетилированных лизинов.
Метилирование гистонов Н3 и Н4 происходит только в NH2-концевой области. Гистон Н3 из тимуса теленка метилируется в Lys-9 и Lys-27, а гистон Н4 — в Lys-20. Оба лизина в гистоне Н3 могут быть моно-, ди- и триметилированы, но в гистоне Н4 триметиллизин не образуется [100, 107, 164]. Гистон Н3 имеет дополнительный центр метилирования — Lys-4. Центры метилирования гистонов Н3 и Н4 так же, как их последовательности аминокислот, чрезвычайно консервативны. Kм и Vmax для метилирования гистонов Н3 и Н4 различны. S-аденозилгомоцистеин — продукт реакции, которую катализирует метилтрансфераза III, — является конкурентным ингибитором субстрата [109, 363].
Метилирование гистонов клеток HeLa происходит главным образом в S-фазе [219]. В культуре ткани метилирование протекает в течение всего клеточного цикла, но максимальная скорость наблюдается между S- и G2-фазами перед началом митоза [320, 350, 352]. Возможно, метилирование необходимо для подготовки хроматина к митозу. После частичной гепатэктомии метилирование гистонов происходит во время важного для клетки периода после S-фазы [218]. Степень метилирования гистонов Н3 и Н4, по-видимому, одна и та же во всех органах, но изменяется с возрастом [107]. У десятидневных крыс молярное соотношение моно-, ди- и триметиллизинов в гистоне Н3 составляет 0,55:1,0:0,35. Молярное соотношение моно- и диметиллизинов в гистоне Н4 в том же возрасте равно 0,1:0,9. С увеличением возраста наблюдается постепенный сдвиг в сторону более метилированных форм. Гистоны Н3 и Н4 в мозгу взрослых крыс не обновляются, так же как не обновляются и их метальные группы независимо от полипептидных цепей [108]. Хонда и др. [165] показали, что метилирование гистонов необратимо и в других тканях. Когда молодым крысам вводили меченый лизин и метионин, значительные количества каждой метки обнаруживали в гистонах мозга. Однако у взрослых особей находили лишь следы этих меток. Если ядра из клеток мозга взрослых крыс инкубировать с S-аденозилметионином, то ни одна метильная группа не включается в гистоны Н3 и Н4. Эти результаты свидетельствуют о том, что метилирование гистонов заканчивается перед наступлением зрелости. Метилированные гистоны могут иметь несколько функций. 1) При метилировании лизиновых остатков, в частности при образовании трифениллизинов, повышается pK ?-NH2-группы лизина и увеличивается основность гистонов. Это может усиливать связь гистонов с ДНК. 2) Метилирование гистонов Н3 и Н4 может играть важную роль в структуре нуклеосом. 3) Метилированные гистоны могут необратимо "запирать" ДНК и препятствовать репликации. Возможно, этим объясняется переход клеток в постмитотическое состояние. 4) Метилированные гистоны могут ингибировать транскрипцию. Для оценки роли метилирования гистонов в структуре и функциях хроматина необходимы дальнейшие исследования.
ADPрибозилирование
Есть сообщения, что поли-ADPрибоза ковалентно связывается с ядерными белками [269, 279]. Было показано, что эта реакция катализируется поли-ADPрибозополимеразой, ассоциированной с хроматином [334]. Молекула фермента из тимуса быка состоит из одной полипептидной цепи с мол. массой 130000; этот фермент полностью активен только в присутствии ДНК [380]. Он связан с межнуклеосомной областью хроматина и, по-видимому, способствует образованию структур хроматина высшего порядка [55]. Субстратом в этой реакции служит NAD+ [56]. Фермент ингибируется никотинамидом, тимидином, цитокининами и метилксантином [226]. В основном ADPрибозилированию как in vivo, так и in vitro подвергается гистон Н1 и до некоторой степени гистон Н2В. Другие нуклеосомные гистоны в печени крыс модифицируются чрезвычайно слабо (если вообще модифицируются) [277, 356]. Центр ADPрибозилирования в гистоне Н1 все еще окончательно не идентифицирован. Было высказано предположение, что он присоединен эфирной связью к глутамату [106]. С помощью фермента в гистон последовательно внедряется от двух до одиннадцати молекул ADPрибозы. Сообщалось о наличии в ядрах клеток из печени крысы разветвленных цепей ADPрибозы, состоящих из 65 остатков [339]. Модификация, по-видимому, происходит следующим образом:
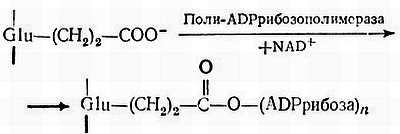
Фосфорилирование серина препятствует ADPрибозилированию [69]. Серии также может быть ADPрибозилирован [277]. Гистон Н6 (белок HMG спермы форели), протамины и некоторые компоненты НГБ также ADPрибозилируются [271, 374, 381]. Связь с ADPрибозой неустойчива в щелочной среде [155]. Поли-(ADPрибозо)гликогидролаза отщепляет полимер от гистона [254]. ADPрибозилированные гистоны легче отделяются от хроматина, чем другие модифицированные гистоны. По-видимому, после ADPрибозилирования связь гистонов с ДНК ослабевает. Это происходит из-за увеличения отрицательных зарядов гистонов и, кроме того, из-за большого размера молекулы, которая способна деформировать структуру хроматина [286]. Функция полимеров ADPрибозы, ковалентно присоединяющихся не только к гистонам, но и к НГБ, еще не установлена. Предполагается, что они участвуют в синтезе и репарации ДНК, в образовании структуры хромосом и в дифференцировке клеток. Содержание ADPрибозополимеразы увеличивается в 3–4 раза в G1-фазе и в процессе дифференцировки эритролейкозных клеток мышей [298]. В клетках HeLa наиболее интенсивное поли-ADPрибозилирование наблюдается в фазе G1, а самое слабое — в фазе S. В результате ADPрибозилирования ядерных белков может происходить их отделение от ДНК, что содействует ее репликации в S-фазе. Таким образом, рассматриваемая модификация может быть необходимой для репликации ДНК. Это подтверждается тем фактом, что синтез ДНК в ядрах, выделенных из печени куриного эмбриона, после ADPрибозилирования увеличивается [341].
Полиамины — спермин, спермидин и путресцин — стимулируют ADPрибозилирование ядерных белков в упомянутом порядке. Стимулирующим эффектом обладает также Mn2+ [340]. ADPрибозилирование гистонов Н1 в клетках HeLa увеличивается в присутствии полиаминов почти в 3 раза [61]. Спермин стимулирует ADPрибозилирование НГБ клеток в культуре, а Mn2+ стимулирует ADPрибозилирование гистонов. Если в инкубационной среде присутствуют и спермин, и Mn2+, то НГБ модифицируются в большей степени, чем гистоны. Таким образом, полиамины и ионы металлов оказывают, по-видимому, регулирующее действие на ADPрибозилирование ядерных белков.
Подводя итоги, можно сказать, что ковалентные модификации хромосомных белков, в частности гистонов, могут оказывать значительное влияние на структуру и функции хроматина. Основные характеристики модифицирующих реакций показаны на рис. 2.4 и заключаются в следующем. 1) Фосфорилирование и ADPрибозилирование происходят в основном в гистоне Н1, а ацетилирование и метилирование — в нуклеосомных гистонах. 2) Фосфорилирование, ADPрибозилирование и ацетилирование приводят к уменьшению общего положительного заряда гистонов и к отделению их от ДНК, тогда как метилирование ведет к увеличению положительного заряда, что делает связь с ДНК более сильной. 3) Гистоны могут претерпевать все эти изменения одновременно, что приводит к значительным изменениям их ионной структуры. 4) Фосфорилирование, очевидно, представляет собой общее явление: оно менее специфично по сравнению с другими модификациями и происходит в делящихся клетках в течение всего клеточного цикла. По-видимому, фосфорилирование необходимо для репликации ДНК и деления клеток. Три другие модификации, вероятно, более специфичны. Ацетилирование происходит главным образом в метаболически активных клетках и, по-видимому, включено в процесс транскрипции. Метилирование, будучи необратимым процессом, может быть важным для репрессии активности генов и для дифференцировки. 5) Все эти модификации специфически модулируются специальными эндогенными эффекторами, в том числе гормонами. Специфические и дифференциальные модификации хромосомных белков могут происходить в разные периоды жизни и приводить к избирательной экспрессии генов.
В то время как накоплено значительное количество данных о ковалентных модификациях гистонов, о подобных модификациях НГБ известно относительно мало. Скудна также информация о скоростях и последовательности дефосфорилирования, деацетилирования и де-ADPрибозилирования.
| <<< Назад Негистоновые хромосомные белки |
Вперед >>> Модуляция модификаций хромосомных белков |
