Книга: Общая химия
196. Коррозия металлов.
| <<< Назад 195. Диаграммы состояния металлических систем. |
Вперед >>> Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ |
196. Коррозия металлов.
Металлические материалы — металлы и сплавы на основе металлов, — приходя в соприкосновение с окружающей их средой (газообразной или жидкой), подвергаются с той или иной скоростью разрушению. Причина этого разрушения лежит в химическом взаимодействии: металлы вступают в окислительно-восстановительные реакции с веществами, находящимися в окружающей среде, и окисляются.
Самопроизвольное разрушение металлических материалов, происходящее под химическим воздействием окружающей среды, называется коррозией (от латинского «corrodere» — разъедать).
Общая масса металлических материалов, используемых в виде различных изделий в мировом хозяйстве, очень велика. Поэтому, несмотря на то, что обычно скорость коррозии мала, ежегодно из-за коррозии безвозвратно теряются огромные количества металла. По ориентировочным подсчетам мировая потеря металла от коррозии выражается величиной 20 миллионов тонн в год. Но еще больший вред связан не с потерей металла, а с порчей изделии, вызываемой коррозией.
- 537 -
Затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, проборов во много раз превышают стоимость металла, из которого они изготовлены. Наконец, существенными бывают косвенные потери, вызванные коррозией. К ним можно отнести, например, утечку нефти или газа из подвергшихся коррозии трубопроводов, порчу продуктов питания, потерю здоровья, а иногда и жизни людей в тех случаях, когда это вызвано коррозией. Таким образом, борьба с коррозией представляет собой важную народнохозяйственную проблему. Поэтому на защиту от коррозии тратятся большие средства.
К важнейшим случаям коррозии относятся коррозия в газах (газовая коррозия) и коррозия в растворах электролитов (электрохимическая коррозия). Коррозия в газах происходит при повышенных температурах, когда конденсация влаги на поверхности металла невозможна. Газовой коррозии подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин и т. п. Газовую коррозию претерпевает также металл, подвергаемый термической обработке. В результате газовой коррозии на поверхности металла образуются соответствующие соединения: оксиды, сульфиды и др.
Для изготовления аппаратуры, подвергающейся действию коррозионноактивных газов, применяют жаростойкие сплавы. Для придания жаростойкости стали и чугуну в их состав вводят хром, кремний, алюминий; применяются также сплавы на основе никеля или кобальта. Защита от газовой коррозии осуществляется, кроме того, насыщением в горячем состоянии поверхности изделия некоторыми металлами, обладающими защитным действием. К таким металлам принадлежат алюминий и хром. Защитное действие этих металлов обусловлено образованием на их поверхности весьма тонкой, но прочной оксидной пленки, препятствующей взаимодействию металла с окружающей средой. В случае алюминия этот метод носит название алитирования, в случае хрома — термохромирования.
К электрохимической коррозии относятся все случаи коррозии в водных растворах. Электрохимической коррозии подвергаются, например, подводные части судов, паровые котлы, проложенные в земле трубопроводы. Коррозия металла, находящегося во влажной атмосфере, также представляет собой электрохимическую коррозию. В результате электрохимической коррозии окисление металла может приводить как к образованию нерастворимых продуктов (например, ржавчины), так и к переходу металла в раствор в виде ионов.
В воде обычно содержится растворенный кислород, способный к восстановлению:
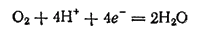
- 538 -
Кроме того, в воде присутствуют ионы водорода, также способные к восстановлению:

Растворенный кислород и ионы водорода — важнейшие окислители, вызывающие электрохимическую коррозию металлов.
Рассмотрим, какие металлы могут быть окислены растворенным в воде кислородом, и какие — ионами водорода. Потенциал, отвечающий электродному процессу
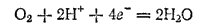
равен (см. табл. 18 на стр. 277):
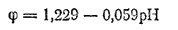
В нейтральных средах (pH=7) он будет иметь значение:
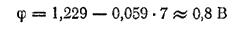
Следовательно, растворенный в воде или в нейтральном водном растворе кислород может окислить те металлы, потенциал которых меньше, чем 0,8 В; они расположены в ряду напряжений от его начала до серебра.
Потенциал, отвечающий электродному процессу
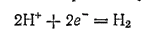
в нейтральной среде, равен приблизительно —0,41 В (см. стр. 282). Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислить только те металлы, потенциал которых меньше, чем —0,41 В, — это металлы от начала ряда напряжений до кадмия. При этом кадмий и металлы, близкие к нему в ряду напряжений, имеют на своей поверхности защитную пленку, препятствующую взаимодействию этих металлов с водой. Поэтому число металлов, которые могут быть окислены ионами водорода в нейтральных средах, еще меньше.
Таким образом, вода, содержащая растворенный кислород, значительно опаснее в коррозионном отношении, чем вода, не содержащая его и способная окислять металлы только ионами водорода.
При использовании металлических материалов очень важным является вопрос о скорости их коррозии. Кроме природы металла и окислителя и содержания последнего, на скорость коррозии могут влиять различные примеси, содержащиеся как в самом металле, так и в коррозионной среде—в атмосфере или в растворе.
При коррозии металла, содержащего включения другого металла, могут наблюдаться, в зависимости от размеров включений, два различных случая.
Включения инородного металла очень малы. Такие включения практически не изменяют величину потенциала основного металла в данном растворе.
- 539 -
В этом случае ускорение коррозии может наблюдаться, если перенапряжение окислительной полуреакции на металле включения меньше, чем на основном металле.
В качестве примера можно указать на коррозию цинка, содержащего небольшие примеси железа или меди, в соляной или в разбавленной серной кислотах. При содержании в цинке сотых долей процента какого-либо из этих металлов скорость взаимодействия его с указанными кислотами в сотни раз выше, чем в случае цинка, подвергшегося специальной очистке. Это объясняется тем, что перенапряжение выделения водорода на меди и на железе ниже, чем на цинке, а лимитирующей стадией (см. § 61) реакции
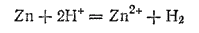
является именно процесс восстановления ионов водорода.
Включения инородного металла не столь малы. Потенциал таких включений отличен от потенциала основного металла. В этом случае, помимо величины перенапряжения окислительной полуреакции на металле включения, на скорость коррозии может повлиять поляризующее действие (см. § 104) металла включения на основной металл. Если металл включения имеет больший потенциал, чем основной металл, то последний поляризуется анодно и скорость его коррозии возрастает. Например, алюминий, содержащий включения железа или меди, корродирует значительно быстрее, чем алюминий высокой чистоты.
Скорость коррозии металла повышается также при включений в него неметаллических примесей, потенциал которых выше потенциала основного металла. Так, включения оксидов или шлаков в стали сильно снижают ее коррозионную стойкость.
Примеси, находящиеся в окружающей среде, могут адсорбироваться на поверхности металла и также каталитически влиять на коррозию, ускоряя или замедляя ее. Например, большинство сплавов железа корродирует в морской воде гораздо быстрее, чем в воде с такой же концентрацией кислорода, не содержащей хлоридов. Это обусловлено тем, что хлорид-ионы, адсорбируясь на поверхности железа, препятствуют образованию на ней защитных слоев.
Как уже говорилось (см. § 100), некоторые металлы в определенных условиях переходят в пассивное состояние — на их поверхности образуются слои или пленки, состоящие из адсорбированного кислорода, из оксида данного металла, или из его соли. Присутствие таких слоев и их структура сильно влияют на скорость коррозии металла; в ряде случаев эти слои обладают защитным действием, вследствие чего металл корродирует лишь ничтожно медленно. В условиях атмосферного воздуха пассивирующие пленки образуются на хроме, никеле, алюминии, цинке.
- 540 -
К важным случаям электрохимической коррозии относятся коррозия в природных водах, в растворах, атмосферная коррозия, коррозия в грунте, коррозия при неравномерной аэрации, контактная коррозия.
Атмосферная коррозия — коррозия во влажном воздухе при обычных температурах. Поверхность металла, находящегося во влажном воздухе, бывает покрыта пленкой воды, содержащей различные газы, и в первую очередь — кислород. Скорость атмосферной коррозии зависит от условий. В частности, на нее влияет влажность воздуха и содержание в нем газов, образующих с водою кислоты (CO2, SO2). Большое значение имеет также состояние поверхности металла: скорость атмосферной коррозии резко возрастает при наличии на поверхности шероховатостей, микрощелей, пор, зазоров и других мест, облегчающих конденсацию влаги.
Коррозия в грунте приводит к разрушению проложенных под землей трубопроводов, оболочек кабелей, деталей строительных сооружений. Металл в этих условиях соприкасается с влагой грунта, содержащей растворенный воздух. В зависимости от состава грунтовых вод, а также от структуры и минералогического состава грунта, скорость этого вида коррозии может быть весьма различной.
Коррозия при неравномерной аэрации — наблюдается в тех случаях, когда деталь или конструкция находится в растворе, но доступ растворенного кислорода к различным ее частям неодинаков. При этом те части металла, доступ кислорода к которым минимален, корродируют значительно сильнее тех частей, доступ кислорода к которым больше. Такое неравномерное распределение коррозии объясняется следующим образом. При восстановлении кислорода
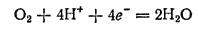
расходуются ионы водорода и раствор, следовательно, несколько подщелачивается. Металлы, и в частности железо, при подщелачивании раствора легче переходят в пассивное состояние. Поэтому аэрируемые участки металла переходят в пассивное состояние и скорость коррозии на них снижается. На неаэрируемых участках не происходит пассивирования — здесь протекает процесс окисления металла, приводящий к переходу его ионов в раствор:
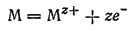
Таким образом, при неравномерной аэрации металла осуществляется пространственное разделение окислительно-восстановительной реакции: восстановление кислорода протекает на более аэрируемых участках, а окисление металла — на менее аэрируемых участках поверхности.
- 541 -
Локализация процесса окисления приводит к местной коррозии — интенсивному разрушению металла на отдельных участках. Местная коррозия приводит к появлению на поверхности металла углублений ("язв"), которые со временем могут превращаться в сквозные отверстия. Иногда развитие язв трудно обнаружить, например, из-за остатков окалины на поверхности металла. Этот вид коррозии особенно опасен для обшивки судов, для промышленной химической аппаратуры и в ряде других случаев.
Контактная коррозия может протекать, когда два металла с различными потенциалами соприкасаются друг с другом либо в водной среде, либо при наличии влаги, конденсирующейся из воздуха. Так же, как и в рассмотренном выше случае значительных включении, металлы оказывают друг на друга поляризующее действие; металл с меньшим потенциалом поляризуется анодно, и скорость его коррозии вблизи места контакта резко возрастает.
Контактная коррозия наблюдается, например, в теплофикационных установках, когда медные нагревательные змеевики соединены с железными кипятильниками или трубами. Интенсивная коррозия железа протекает около мест соединения. Однако соотношение между потенциалами контактирующих металлов зависит не только от природы металлов, но также от природы растворенных в воде веществ, от температуры и от других условий и не всегда соответствует взаимному положению металлов в ряду напряжений. Так, в случае контакта железо — цинк последний интенсивно корродирует при комнатной температуре, но в горячей воде полярность металлов изменяется и растворяться начинает железо.
Для предупреждения коррозии и защиты от нее применяются разнообразные методы. К важнейшим из них относятся следующие:
1) применение химически стойких сплавов;
2) защита поверхности металла покрытиями;
3) обработка коррозионной среды;
4) электрохимические методы.
Из химически стойких сплавов наиболее широкое применение имеют нержавеющие стали, в состав которых входит до 18% хрома и до 10% никеля.
Покрытия, применяемые для защиты металлов, подразделяются на металлические, неметаллические и образованные в результате химической или электрохимической обработки поверхности металла.
В качестве металлов для покрытия обычно применяют металлы, образующие на своей поверхности защитные пленки. Как уже говорилось, к таким металлам относятся хром, никель, цинк, кадмий, алюминий, олово и некоторые другие. Значительно реже применяются металлы, имеющие высокий электродный потенциал — серебро, золото.
- 542 -
Существуют различные способы нанесения металлических покрытий; наибольшие преимущества имеют методы гальванотехники (см. § 103).
К неметаллическим относятся покрытия лаками, красками, эмалями, феиолоформальдегидными и другими смолами. Для длительной защиты от атмосферной коррозии металлических сооружений, деталей, машин, приборов чаще всего применяются лакокрасочные покрытия.
Покрытия, создаваемые химической или электрохимической обработкой металла, представляют собой в основном защитные оксидные или солевые пленки. Примерами могут служить оксидирование алюминия (создание на его поверхности стойких оксидных пленок), фосфатирование стальных изделий (создание защитных пленок, состоящих из фосфатов).
Метод обработки внешней среды пригоден для случаев, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Метод состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода (деаэрация) или в добавлении к этому раствору веществ, замедляющих коррозию, — ингибиторов. В зависимости от природы металла и раствора применяются различные ингибиторы: нитрит натрия, хромат и дихромат калия, фосфаты натрия, некоторые высокомолекулярные органические соединения и другие. Защитное действие этих веществ обусловлено тем, что их молекулы или ионы адсорбируются на поверхности металла и каталитически снижают скорость коррозии, а некоторые из них (например, хроматы и дихроматы) переводят металл в пассивное состояние.
К электрохимическим методам защиты металлов относятся катодная защита и метод протекторов. При катодной защите защищаемая конструкция или деталь присоединяется к отрицательному полюсу источника электрической энергии и становится катодом. В качестве анодов используются куски железа. При надлежащей силе тока в цепи на защищаемом изделии происходит восстановление окислителя, процесс же окисления претерпевает вещество анода.
Метод протекторов осуществляется присоединением к защищаемому металлу большого листа, изготовленного из другого, более активного металла — протектора. В качестве протектора при защите стальных изделий обычно применяют цинк или сплавы на основе магния. При хорошем контакте между металлами защищаемый металл (железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие. Согласно взаимному положению этих металлов в ряду напряжений, железо поляризуется катодно, а цинк — анодно. В результате этого на железе идет процесс восстановления того окислителя, который присутствует в воде (обычно растворенный кислород), а цинк окисляется.
И протекторы, и катодная защита применимы в средах, хорошо проводящих электрический ток, например в морской воде. В частности, протекторы широко применяются для защиты подводных частей морских судов. Ясно, что убытки, вызванные коррозией корпуса морского судна и связанные с его простоем и ремонтом, очень велики и во много раз превышают стоимость протекторов,
| <<< Назад 195. Диаграммы состояния металлических систем. |
Вперед >>> Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ |
- 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
- 191. Кристаллическое строение металлов.
- 192. Добывание металлов из руд.
- 193. Получение металлов высокой чистоты.
- 194. Сплавы.
- 195. Диаграммы состояния металлических систем.
- 196. Коррозия металлов.
- 950. Какие концентрации тяжелых металлов вредны для морских организмов?
- Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
- 6.40. ИОДНОЕ РАФИНИРОВАНИЕ МЕТАЛЛОВ
- 5.39. ЗАГАДКА О ЦАРЕ МЕТАЛЛОВ
- 197. Щелочные металлы в природе. Получение и свойства щелочных металлов.
- Платиновые металлы 245. Общая характеристика платиновых металлов.
- 100. Ряд напряжений металлов.
- 191. Кристаллическое строение металлов.
- 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
- 193. Получение металлов высокой чистоты.
- 192. Добывание металлов из руд.
- Висмут — среди металлов
