Книга: Общая химия
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
| <<< Назад Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ |
Вперед >>> 191. Кристаллическое строение металлов. |
190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
Металлы обладают рядом общих свойств. К общим физическим свойствам металлов относятся их высокая электрическая проводимость и теплопроводность, пластичность, т. е. способность подвергаться деформации при обычных и при повышенных температурах, не разрушаясь. Пластичность металлов имеет очень большое практическое значение. Благодаря этому свойству металлы поддаются ковке, прокатке, вытягиванию в проволоку (волочению), штамповке.
- 514 -
Металлам присущи также металлический блеск, обусловленный их способностью хорошо отражать свет, и непрозрачность*. В табл. 29 приведены значения удельного электрического сопротивления и теплопроводности некоторых металлов. Для сравнения в ней даны сведения для двух неметаллов.
Таблица 29. Удельное электрическое сопротивление ? и коэффициент теплопроводности ? некоторых простых веществ при 20°C.
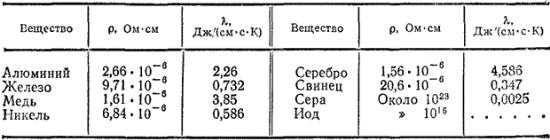
В химическом отношении все металлы характеризуются сравнительной легкостью отдачи валентных электронов и, как следствие этого, способностью образовывать положительно заряженные ионы и проявлять в своих соединениях только положительную окисленность. Многие металлы, например железо, хром, марганец, имеют в различных соединениях разную степень окисленности, но она всегда положительна. В связи с этим металлы в свободном состоянии являются восстановителями. Восстановительная способность разных металлов неодинакова. Для реакций в водных растворах она определяется положением металла в ряду напряжений и концентрацией (активностью) его ионов в растворе.
Причина общности как физических, так и химических свойств металлов лежит в общности строения их атомов и природы кристаллических решеток металлов.
Общей особенностью атомов металлов являются их большие в сравнении с атомами неметаллов размеры (см. § 33). Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо - атомы металлов характеризуются низкими потенциалами ионизации (см. § 34, табл. 4 и 5) и близким к нулю или отрицательным сродством к электрону. Именно поэтому металлы легко отдают валентные электроны, выступая в качестве восстановителей, и, как правило, не способны присоединять электроны — проявлять окислительные свойства.
Рассмотрим особенности строения металлов в кристаллическом состоянии. Как отмечалось, металлы обладают высокой электрической проводимостью, причем переносчиками тока в металлах служат электроны.
* В высокодисперсном состоянии металлы обычно имеют черный цвет и не блестят.
- 515 -
Это говорит о том, что в металлах имеются «свободные» электроны, способные перемещаться по кристаллу 6 под действием даже слабых электрических полей.
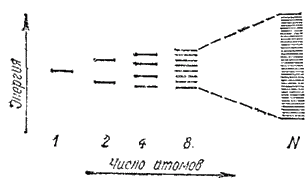
Рис. 135. Схема образования энергетических уровней при увеличении числа взаимодействующих атомов.
В то же время неметаллы в кристаллическом состоянии обычно представляют собою изоляторы и, следовательно, не содержат свободных электронов. Причины этих различий можно объяснить на основе метода молекулярных орбиталей (метод МО).
В § 45 было показано, что при взаимодействии двух одинаковых атомов вместо двух энергетически равноценных исходных атомных орбиталей образуются две молекулярные орбитали, отвечающие различным уровням энергии (рис. 45). Если взаимодействуют три атома, причем их валентные орбитали заметно перекрываются, то возникают не две, а три молекулярные орбитали, в равной степени принадлежащие всем трем атомам (делокализованные орбитали) и характеризующиеся тремя различными значениями энергии. При последовательном увеличении числа взаимодействующих атомов добавление каждого из них приводит к образованию еще одного энергетического уровня и к дальнейшей делокализации молекулярных орбиталей (т. е. к распространению их на большее число атомов); общее число энергетических уровней будет при этом равно числу взаимодействующих атомов. Схема подобного процесса представлена на рис. 135.
Как показывает эта схема, с ростом числа атомов возрастает число разрешенных энергетических состояний, а расстояния между соседними энергетическими уровнями уменьшаются. При небольшом числе взаимодействующих атомов для перевода электрона с какого-либо энергетического уровня на ближайший более высокий уровень необходима затрата сравнительно большой энергии. Но при большом числе атомов N (в макроскопическом кристалле N имеет порядок числа Авогадро) соседние уровни настолько мало различаются, что образуется практически непрерывная энергетическая зона, и переход электрона на ближайший более высокий уровень может осуществиться при затрате ничтожно малой энергии. Если такой ближайший уровень не занят электронами, то находящийся на предшествующем уровне электрон ведет себя как "свободный"; вследствие делокализованности орбиталей он может перемещаться по кристаллу при сколь угодно малых энергетических воздействиях.
Заполнение электронами МО, составляющих энергетическую зону, происходит в порядке последовательного возрастания энергии. При этом, в соответствии с принципом Паули, на каждой МО может размещаться по два электрона.

Рис. 136. Схема заполнения электронами энергетических уровней в кристалле щелочного металла: а — занятые уровни (валентная зона); б — незанятые уровни (зона проводимости).

Рис. 137. Схема заполнения электронами энергетических уровней в кристалле металла главной подгруппы второй группы: а — валентная зона, образованная из исходных внешних s-орбиталей; б — зона проводимости, образованная из исходных внешних p-орбиталей.
В кристалле какого-нибудь щелочного металла, например калия, атомные орбитали внутренних электронных слоев практически не перекрываются. Можно считать, что в этом случае непрерывная энергетическая зона создается только за счет орбиталей внешнего электронного слоя и заполняется электронами этого слоя. В кристалле, содержащем N атомов, из исходных атомных s-орбиталей внешнего слоя образуется энергетическая зона, состоящая из N уровней. В этой зоне размещаются N внешних s-электронов атомов щелочного металла, которые занимают N/2 энергетических уровней (по два электрона на каждом уровне). Совокупность этих занятых валентными электронами уровней называется валентной зоной. В рассматриваемом случае валентная зона занимает лишь половину имеющихся энергетических уровней. Остальные уровни остаются незаполненными, образуя зону проводимости (рис. 136). Здесь в непосредственной близости от верхних занятых уровней имеются свободные уровни, на которые могут переходить электроны под действием электрического поля. Это и создает возможность переноса тока электронами — обеспечивает электрическую проводимость металла.
В кристалле металла главной подгруппы второй группы (например, кальция) из исходных атомных s-орбиталей наружного слоя также образуется зона, состоящая из N уровней. Но, поскольку здесь каждый атом обладает двумя внешними s-электронами, то в этой зоне должно разместиться 2N электронов, так что все ее уровни окажутся полностью занятыми. Однако при взаимодействии атомов металла перекрываются не только внешние s-орбитали, но и внешние р-орбитали. В результате также образуется непрерывная энергетическая зона, не заполненная электронами. При этом зоны, образованные s- и р-орбиталями, перекрываются (рис. 137), так что и в этом случае зона проводимости, содержащая свободные энергетические уровни, непосредственно примыкает к валентной зоне.
Таким образом, рассматриваемый кристалл также должен обладать высокой электрической проводимостью.
На рис. 136 и 137 изображена резкая граница между валентной зоной и зоной проводимости. В действительности эта граница размыта; вследствие теплового движения электроны могут переходить с верхних уровней валентной зоны на нижние уровни зоны проводимости. Способность этих электронов свободно передвигаться по кристаллу и переносить энергию из одной его части (нагретой) в другую (более холодную) служит причиной высокой теплопроводности металлов. Таким образом, и электрическая проводимость и теплопроводность металлов обусловлены возможностью свободного передвижения электронов зоны проводимости. Именно поэтому для большинства металлов наблюдается параллелизм между этими величинами. Например, лучшие проводники электричества — серебро и медь — обладают и наиболее высокой теплопроводностью (см. табл. 29).
При нагревании колебания атомов металла около их равновесных положений в кристаллической решетке становятся более интенсивными, что затрудняет движение электронов. Поэтому с повышением температуры электрическое сопротивление металлов возрастает.
Рассмотренная картина электронного строения твердых металлов показывает, что валентные электроны, осуществляющие химическую связь, принадлежат не двум или нескольким определенным атомам, а всему кристаллу металла. При этом валентные электроны способны свободно перемещаться в объеме кристалла. Образованную подобным образом химическую связь называют металлической связью, а совокупность «свободных» электронов в металле — электронным газом. Металлическая связь характерна для металлов, их сплавов и интерметаллических соединений (см. стр. 534).
Пластичность металлов также объясняется специфическими свойствами металлической связи. При механическом воздействии на твердое тело отдельные слои его кристаллической решетки вращаются относительно друг друга. В кристаллах с атомной структурой это приводит к разрыву ковалентных связей между атомами, принадлежащими различным слоям, и кристалл разрушается. В кристаллах с ионной структурой при взаимном смещении слоев неизбежно создается такое положение, при котором рядом оказываются одноименно заряженные ионы; при этом возникают силы электростатического отталкивания и кристалл также разрушается. В случае же металла при смещении отдельных слоев его кристаллической решетки происходит лишь некоторое перераспределение электронного газа, связывающего друг с другом атомы металла, но разрыва химических связей не происходит — металл деформируется, не разрушаясь.
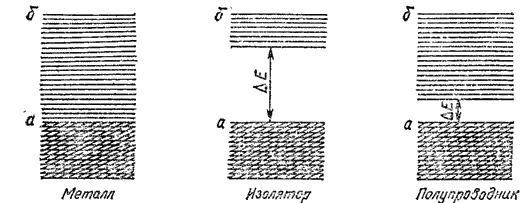
Рис. 138. Схема расположения энергетических зон в металле, изоляторе и полупроводнике: а — валентная зона; б — зона проводимости.
В отличие от металлов кристаллы простых веществ, образованных неметаллами, обычно не обладают заметной электронной проводимостью (см. табл. 29); они представляют собою изоляторы (диэлектрики). Хотя в этом случае тоже возможно образование непрерывных энергетических зон, но здесь зона проводимости отделена от валентной зоны запрещенной зоной, т. е. значительным энергетическим промежутком ?E (рис. 138, изолятор). Энергия теплового движения или слабого электрического поля оказывается недостаточной для преодоления этого промежутка, и электроны не переходят из валентной зоны в зону проводимости. Таким образом, в изоляторах электроны не могут свободно перемещаться по кристаллу и служить переносчиками электрического тока.
Особыми свойствами, отличающими их как от металлов, так и от изоляторов, обладают полупроводники. При низких температурах их электрическое сопротивление весьма велико и в этих условиях они проявляют свойства изоляторов. Однако при нагревании или при освещении электрическая проводимость полупроводников резко возрастает и может достигать величин, сравнимых с проводимостью металлов.
Зависимость электрических свойств полупроводников от температуры и освещенности объясняется электронным строением их кристаллов. Здесь, как и у изоляторов, валентная зона отделена от зоны проводимости запрещенной зоной (рис. 138, полупроводник). Однако ширина запрещенной зоны ?E в случае полупроводников невелика. Поэтому при действии квантов лучистой энергии или при нагревании электроны, занимающие верхние уровни валентной зоны, могут переходить в зону проводимости и участвовать в переносе электрического тока. С повышением температуры или при увеличении освещенности число электронов, переходящих в зону проводимости, возрастает; в соответствии с этим увеличивается и электрическая проводимость полупроводника.
При переходе электронов в зону проводимости в валентной зоне возникают не полностью занятые электронами энергетические уровни — электронные вакансии, или «дырки».
- 519 -
В электрическом поле такие дырки ведут себя как положительные электрические заряды. Поэтому перенос тока в полупроводниках может осуществляться как электронами зоны проводимости (от латинского «negative» — отрицательный), так и дырками валентной зоны (р-проводимость, от латинского «positive» — положительный).
| <<< Назад Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ |
Вперед >>> 191. Кристаллическое строение металлов. |
- 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
- 191. Кристаллическое строение металлов.
- 192. Добывание металлов из руд.
- 193. Получение металлов высокой чистоты.
- 194. Сплавы.
- 195. Диаграммы состояния металлических систем.
- 196. Коррозия металлов.
- § 9. Строение и эволюция Вселенной
- 7. СТРОЕНИЕ И ОСОБЕННОСТИ ЖИЗНЕДЕЯТЕЛЬНОСТИ ЖИВЫХ ОРГАНИЗМОВ
- Построение профиля рельефа по карте
- § 1. Строение и состав Солнечной системы. Две группы планет
- § 17. Физические свойства и химический состав Земли
- Строение ВТМ
- § 52. Растения, их строение. Вегетативные органы
- § 44. Строение клетки
- 3. ВНУТРЕННЕЕ СТРОЕНИЕ И РЕЛЬЕФ ЗЕМЛИ
- § 30. Состав и строение атмосферы
- 2. Строение клеточной стенки и цитоплазматической мембраны
- Природа России РЕЛЬЕФ. Геологическое Строение и Полезные Ископаемые
