Книга: Общая химия
11. Парциальное давление газа.
| <<< Назад 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии. |
Вперед >>> 12. Эквивалент. Закон эквивалентов. |
11. Парциальное давление газа.
При определении молекулярных масс газов очень часто приходится измерять объем газа, собранного над водой и потому насыщенного водяным паром. Определяя в этом случае давление газа, необходимо вводить поправку на парциальное давление водяного пара.
При обычных условиях различные газы смешиваются друг с другом в любых соотношениях. При этом каждый газ, входящий в состав смеси, характеризуется своим парциальным давлением. Оно представляет собой то давление, которое производило бы имеющееся в смеси количество данного газа, если бы оно одно занимало при той же температуре весь объем, занимаемый смесью.
Установленный Дальтоном закон парциальных давлений гласит:
Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь.
- 29 -
Пусть над водой собрано 570 мл газа при температуре 20?C и давлении 104,1 кПа. Это давление складывается из двух величин — парциального давления самого газа и давления насыщенного водяного пара. Последнее при каждой температуре имеет вполне определенную величину, а частности при 20?C оно равно 2,34 кПа (см. стр. 202). Следовательно, парциальное давление газа в данном случае равно 104,1-2,34 = 101,76 кПа. Приводя измеренный объем газа к нормальным условиям, следует подставить в уравнение не общее давление газовой смеси (104,1 кПа), а парциальное давление газа (101,76 кПа):

Если не учитывать поправку на давление паров воды, то вместо найденного объема получим
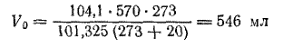
Ошибка составит 13 мл, т.е. 2,5%, что можно допустить только при ориентировочных расчетах.
Все рассмотренные газовые законы — закон Дальтона, закон простых объемных отношений Гей-Люссака и закон Авогадро, - приближенные законы. Они строго соблюдаются при очень малых давлениях, когда среднее расстояние между молекулами значительно больше их собственных размеров, и взаимодействие молекул друг с другом практически отсутствует. При обычных невысоких давлениях они соблюдаются приближенно, а при высоких давлениях наблюдаются большие отклонения от этих законов.
| <<< Назад 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии. |
Вперед >>> 12. Эквивалент. Закон эквивалентов. |
- 4. Закон сохранения массы.
- 5. Основное содержание атомно-молекулярного учения.
- 6. Простое вещество и химический элемент.
- 7. Закон постоянства состава. Закон кратных отношений.
- 8. Закон объемных отношений. Закон Авогадро.
- 9. Атомные и молекулярные массы. Моль.
- 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
- 11. Парциальное давление газа.
- 12. Эквивалент. Закон эквивалентов.
- 13. Определение атомных масс. Валентность.
- 14. Химическая символика.
- 15. Важнейшие классы и номенклатура неорганических веществ.
- 16. Химические расчеты.
- § 35. Давление атмосферы
- Подавление устойчивости
- Гидростатическое давление как в морских глубинах
- Социальное давление
- 229. Каково давление на дне океана?
- 228. На сколько увеличивается давление с глубиной?
- 411. Какое минимальное давление воздуха было зарегистрировано в урагане или тайфуне?
- § 18. Вес воздуха и атмосферное давление
- 692. Почему глубоководные рыбы способны выдерживать огромное давление?
- 604. Какое давление способны выдержать млекопитающие?
- 25. Причина приливов не притяжение Луны, а давление нагреваемой Солнцем атмосферы
- Кто первым измерил атмосферное давление?
