Книга: Общая химия
117. Пероксид водорода H2O2
| <<< Назад 116. Свойства и применение водорода. |
Вперед >>> Глава XII. ГАЛОГЕНЫ |
117. Пероксид водорода H2O2
. Пероксид (перекись) водорода представляет собой бесцветную сиропообразную жидкость плотностью 1.45 г/см3, затвердевающую при —0.48°C. Это очень непрочное вещество, способное разлагаться со взрывом на воду и кислород, причем выделяется большое количество теплоты:
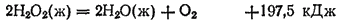
Водные растворы пероксида водорода более устойчивы; в прохладном месте они могут сохраняться довольно долго. Пергидроль — раствор, который поступает в продажу, — содержит 30% H2O2. В нем, а также в высококонцентрированных растворах пероксида водорода содержатся стабилизирующие добавки.
Разложение пероксида водорода ускоряется катализаторами. Если, например, в раствор пероксида водорода бросить немного диоксида марганца MnO2, то происходит бурная реакция и выделяется кислород. К катализаторам, способствующим разложению пероксида водорода, принадлежат медь, железо, марганец, а также ионы этих металлов. Уже следы этих металлов могут вызвать распад H2O2.
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода, но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород.
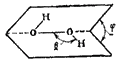
Рис. 108. Схема строения молекулы H2O2. Угол ? близок к 100°, угол ? — к 95°. Длины связей: O-O 0.149 нм.
Однако если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода.
Пероксид водорода получается также при действии атомарного водорода на кислород.
В промышленности пероксид водорода получают в основном электрохимическими методами, например анодным окислением растворов серной кислоты или гидросульфата аммония с последующим гидролизом образующейся при этом пероксодвусерной кислоты H2S2O8(см. § 132). Происходящие при этом процессы можно изобразить схемой:
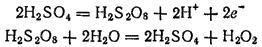
В пероксиде водорода атомы водорода ковалентно связаны с атомами кислорода, между которыми также осуществляется простая связь. Строение пероксида водорода можно выразить следующей структурной формулой: Н—О—О—Н.
Молекулы H2O2 обладают значительной полярностью (?=2.13D), что является следствием их пространственной структуры (рис. 106).
В молекуле пероксида водорода связи между атомами водорода и кислорода полярны (вследствие смещения общих электронов в сторону кислорода). Поэтому в водном растворе под влиянием полярных молекул воды пероксид водорода может отщеплять ионы водорода, т. е. он обладает кислотными свойствами. Пероксид водорода — очень слабая двухосновная кислота (K1 = 2.6·10-12) в водном растворе он распадается, хотя и в незначительной степени, на ионы:
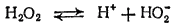
Диссоциация по второй ступени
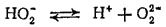
практически не протекает. Она подавляется присутствием воды — вещества, диссоциирующего с образованием ионов водорода в большей степени, чем пероксид водорода. Однако при связывании ионов водорода (например, при введении в раствор щелочи) диссоциация по второй ступени происходит.
С некоторыми основаниями пероксид водорода реагирует непосредственно, образуя соли.
- 337 -
Так, при действии пероксида водорода на водный раствор гидроксида бария выпадает осадок бариевой соли пероксида водорода:
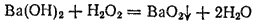
Соли пероксида водорода называются пероксидами или перекисями. Они состоят из положительно заряженных ионов металла и отрицательно заряженных ионов O22- , электронное строение которых можно изобразить схемой:
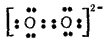
Степень окисленности кислорода в пероксиде водорода равна —1, т. е. имеет промежуточное значение между степенью окисленности кислорода в воде (-2) и в молекулярном кислороде (0). Поэтому пероксид водорода обладает свойствами как окислителя, так и восстановителя, т. е. проявляет окислительно-восстановительную двойственность. Все же для него более характерны окислительные свойства, так как стандартный потенциал электрохимической системы
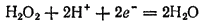
в которой H2O2 выступает как окислитель, равен 1,776 В, в то время как стандартный потенциал электрохимической системы
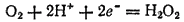
в которой пероксид водорода является восстановителем, равен 0,682 В. Иначе говоря, пероксид водорода может окислять вещества,?° которых не превышает 1,776 В, а восстанавливать только те, ?° которых больше 0,682 В. По табл. 18 (на стр. 277) можно видеть, что в первую группу входит гораздо больше веществ.
В качестве примеров реакций, в которых H2O2 служит окислителем, можно привести окисление нитрита калия
KNO2 + H2O2 = KNO3 + H2O
и выделение иода из иодида калия:
2KNI + H2O2 = I2 + 2KOH
Как пример восстановительной способности пероксида водорода укажем на реакции взаимодействия H2O2 с оксидом серебра(I)
Ag2O + H2O2 = 2Ag + H2O + O2
а также с раствором перманганата калия в кислой среде:
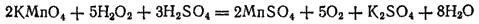
Если сложить уравнения, отвечающие восстановлению пероксида водорода и его окислению, то получится уравнение самоокисления-самовосстановления пероксида водорода:
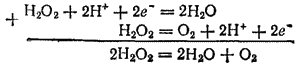
- 338 -
Это — уравнение процесса разложения пероксида водорода, о котором говорилось выше.
Применение пероксида водорода связано с его окислительной способностью и с безвредностью продукта его восстановления (H2O). Его используют для отбелки тканей и мехов, применяют в медицине (3% раствор — дезинфицирующее средство), в пищевой промышленности (при консервировании пищевых продуктов), в сельском хозяйстве для протравливания семян, а также в производстве ряда органических соединений, полимеров, пористых материалов. Как сильный окислитель пероксид водорода используется в ракетной технике.
Пероксид водорода применяют также для обновления старых картин, написанных масляными красками и потемневших от времени вследствие превращения свинцовых белил в черный сульфид свинца под действием содержащихся в воздухе следов сероводорода. При промывании таких картин пероксидом водорода сульфид свинца окисляется в белый сульфат свинца:
PbS + H2O2 = PbSO4 + 4H2O
| <<< Назад 116. Свойства и применение водорода. |
Вперед >>> Глава XII. ГАЛОГЕНЫ |
