Книга: От атомов к древу. Введение в современную науку о жизни
Кратко про атомы
| <<< Назад 1. Углерод |
Вперед >>> Химические связи |
Кратко про атомы
Итак, атомы.
Уже довольно давно известно, что они состоят из трех типов элементарных частиц: протонов, нейтронов и электронов (см. рис. 1.1А). Протоны и нейтроны — частицы относительно массивные, любой из них примерно в 1800 раз тяжелее электрона. Из протонов и нейтронов состоит атомное ядро, а из электронов — внешняя оболочка атома, которую обычно прямо так и называют электронной оболочкой. Электроны, образующие оболочку, перемещаются вокруг ядра по чрезвычайно сложным траекториям, но, как правило, не слишком от него удаляясь.
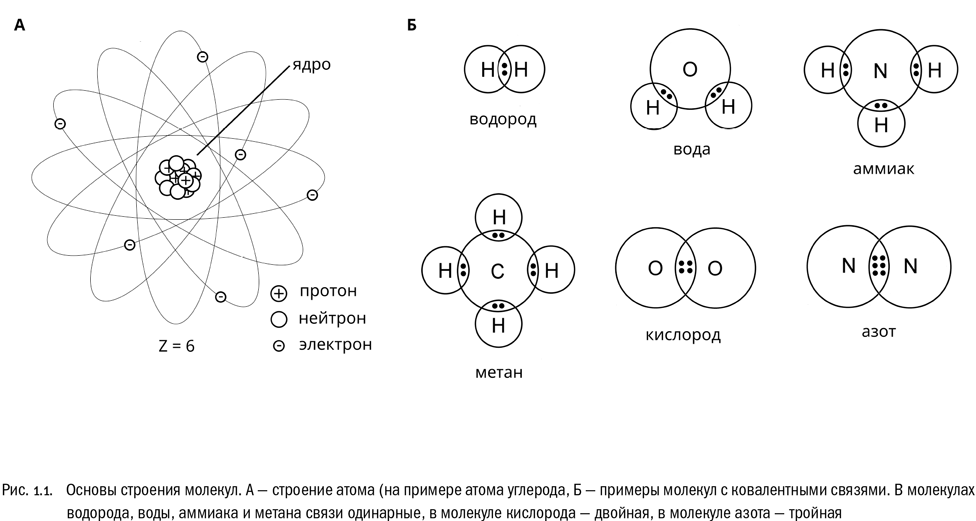
Самое важное для нас свойство элементарных частиц даже не масса, а электрический заряд. Здесь действуют абсолютно четкие и очень простые закономерности.
• Протон электрически заряжен положительно, электрон — отрицательно, а нейтрон не имеет никакого заряда.
• По величине отрицательный заряд электрона строго равен положительному заряду протона. Принято считать, что протон имеет заряд +1, а электрон ?1.
• Число электронов в атоме по умолчанию равно числу протонов, так что заряд целого атома равен нулю. Если же число электронов отличается от числа протонов, значит, перед нами не просто атом, а заряженная частица — ион.
Физики еще в XVIII веке выяснили, что электрические заряды бывают двух типов: положительные и отрицательные. Также они обнаружили, что разноименные заряды притягиваются, а одноименные отталкиваются. Этот закон называется основным законом электростатики, или законом Кулона (на самом деле он записывается формулой, позволяющей точно определить силу притяжения или отталкивания, но мы тут обойдемся без математики). Закон Кулона действует где угодно, в том числе и внутри атома. Собственно говоря, электроны и протоны потому и образуют единый атом, что они электростатически притягиваются друг к другу. Для справки добавим, что протоны и нейтроны «склеиваются» в атомное ядро притяжением совсем другого рода — так называемым сильным ядерным взаимодействием, которое на маленьких расстояниях гораздо мощнее электростатического. Именно поэтому протоны в ядре держатся вместе, несмотря на отталкивающую их друг от друга кулоновскую силу.
Самый главный параметр любого атома — это число протонов, или атомный номер (Z). Величина Z однозначно определяет положение данного атома в периодической системе элементов, то есть в таблице Менделеева. Как мы уже знаем, число электронов обычно равно числу протонов. А вот что касается числа нейтронов, то оно может при одном и том же числе протонов быть разным. Атомы, имеющие одинаковый атомный номер, но разное число нейтронов, называются изотопами. Если слово «изотопы» не упоминается, значит, число нейтронов нам в данном случае неважно. Все атомы, имеющие одинаковое число протонов, по определению относятся к одному химическому элементу.
Самый простой из всех возможных атомов — водород (Z=1). Он состоит из одного протона и одного электрона. Нейтронов в нем может не быть вовсе (хотя могут и быть, в зависимости от того, какой это изотоп). Если лишить обычный простейший атом водорода его единственного электрона, от него останется положительно заряженный ион, в данном случае представляющий собой не что иное, как «голый» протон.
Еще в начале XIX века английский химик и врач Уильям Праут выдвинул опередившую свое время гипотезу, что атомы всех других химических элементов образуются в результате объединения того или иного количества атомов водорода[6]. И он был не так уж далек от истины. Все атомы действительно состоят из однотипных частиц, самый простой возможный набор которых дает не что иное, как атом водорода (Z=1). Второй по сложности атом — гелий (Z=2), третий — литий (Z=3), ну а дальше в нашем распоряжении вся таблица Менделеева. Самые тяжелые атомы содержат больше сотни протонов и около двух сотен нейтронов. Но с такими чудовищами мы в биологии не встретимся.
| <<< Назад 1. Углерод |
Вперед >>> Химические связи |
- Межклеточное вещество
- 04. На что влияет нагрев планет звездами, звезд Ядрами Галактик, Ядер Галактик Ядрами Сверхгалактик
- Список литературы
- Разные человечества
- Красные тучи, закрывающие солнце
- Московская белая
- Муравей, семья, колония
- Примерные рационы для котят от месяца до пяти и старше
- Голосеменные растения завоевывают мир
- Пароль скрещенных антенн
- Позор страны
- Что такое водопад?
