Книга: Происхождение жизни. От туманности до клетки
Альтернативная биохимия на тех же элементах
| <<< Назад Выбор химических элементов |
Вперед >>> Альтернативные варианты биохимии на древней Земле. Ксенонуклеиновые кислоты |
Альтернативная биохимия на тех же элементах
Как мы видим, реальной альтернативы углероду, кислороду и азоту не существует. Но, может быть, на основе этих же элементов возможна другая биохимия, непохожая на земную? Такое исключить нельзя. Возможны, например, другие растворители, кроме воды, и в них неизбежно будет совсем другая биохимия. Единственное действительно уникальное свойство воды – меньшая плотность льда по сравнению с жидкой водой. Благодаря этому водоемы зимой замерзают с поверхности, и потом слой льда замедляет потерю тепла и предотвращает полное промерзание. В озерах из других жидкостей при охлаждении твердое вещество будет тонуть, и полное промерзание наступит быстро. С точки зрения обитателей озера эта особенность воды очень полезна. Но для биосферы в целом, наоборот, такое поведение воды вредно. Лед на поверхности озер и морей отражает солнечный свет гораздо лучше, чем вода, что приводит к дополнительному остыванию планеты. Поэтому наступление ледников – самоподдерживающийся процесс. Если бы вместо воды наши моря состояли из любой другой жидкости, то климат планеты Земля был бы устойчивее.
Очевидный кандидат на замену воды – жидкий аммиак. Его молекулы тоже полярны и образуют много водородных связей, он остается жидким в широком диапазоне температур (от –78 до –33 °C при обычном давлении) и хорошо растворяет разные полярные вещества. В аммиачном растворе биохимия неизбежно будет другой, так как карбонильные (С=О) группы, очень важные для нашей земной биохимии, в аммиаке быстро превращаются в иминогруппы (C=NH). В среде аммиака иминогруппы обеспечивают такие же перестройки углеродных скелетов, как C=O в воде. Аммиак по сравнению с водой имеет тот недостаток, что в нем гораздо лучше растворяются неполярные молекулы. Поэтому липидные мембраны, ограничивающие наши клетки в водной среде, в аммиаке будут работать плохо.
Если мы посмотрим на нашу Солнечную систему, то увидим, что, в отличие от воды, аммиак в чистом виде в ней не встречается. Везде, где есть много аммиака, он смешан с водой и часто еще с метаном, будь то бездонные океаны Урана и Нептуна, ледяные кометы, спутники дальних планет и объекты пояса Койпера. На Титане водяной лед содержит 10–15 % аммиака. Под ледяной корой Титана находится глубокий водно-аммиачный океан. Водно-аммиачная смесь по нескольким признакам лучше подходит для биохимии, чем чистый аммиак. По сравнению с ним она замерзает при еще более низких температурах (до –96 °C) и не растворяет углеводороды, поэтому в ней возможно существование липидных мембран, как и в воде. В водно-аммиачной смеси реакции обмена веществ могут происходить с помощью как С=О групп, так и C=NH, что допускает б?льшую гибкость, чем наша земная биохимия.
Еще один возможный растворитель – серная кислота. Она замерзает при +10 °C и кипит при +290 °C, прекрасно растворяет разные вещества и встречается в космосе в чистом виде, например в облаках Венеры. На поверхности планет, потерявших воду аналогично Венере, но более прохладных, возможно существование жидкой серной кислоты. В серной кислоте достаточно легко идут разные химические реакции, и роль карбонильной группы С=О в ней может играть просто двойная связь между атомами углерода: С=СН2 (рис. 12.6).
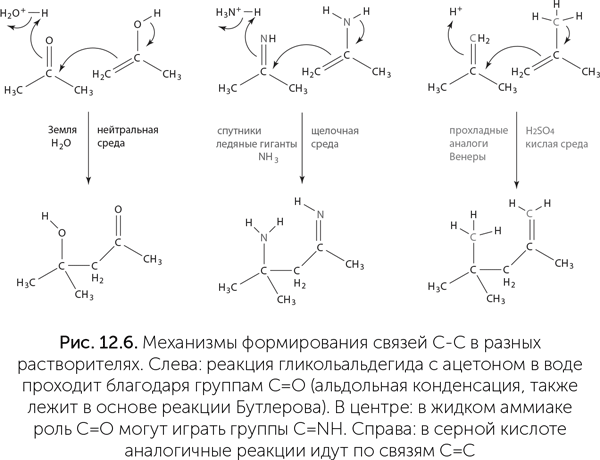
Хотя мы не можем предсказать, какие молекулы будут использоваться живыми существами в аммиаке или серной кислоте, понятно, что наши азотистые основания не подойдут для генетических полимеров в такой среде. Уотсон-криковские пары образуются только в нейтральной среде (pH от 6 до 9). В кислой среде к аминогруппам (NH2) аденина и цитозина присоединяются протоны, дающие положительный заряд, а в щелочной среде, наоборот, гуанин и урацил теряют протоны и получают отрицательный заряд на месте карбонильной группы (С=О). И то и другое нарушает водородные связи между основаниями и делает эти основания непригодными для хранения генетической информации. Поэтому все микробы, населяющие сильнокислые или щелочные среды на Земле, поддерживают внутри клетки нейтральный pH, даже если на это уходит много энергии.
Еще воду можно заменить жидкой углекислотой. При обычном давлении она не существует (сухой лед сразу переходит в газ, минуя жидкую стадию), но при повышении давления становится жидкостью. При давлении 70 атмосфер СО2 остается жидким в диапазоне температур от –50 до +31 °C, а при более высоких температурах и уровнях давления переходит в сверхкритическое состояние. Сверхкритическое состояние вещества наступает при температуре и давлении выше критической точки (для СO2 это 31 °C и 74 атмосферы, для воды – 374 °C и 218 атмосфер), оно сочетает плотность жидкости и подвижность газа и растворяет разные вещества гораздо активнее, чем обычная жидкость.
Жидкая углекислота растворяет многие вещества не хуже воды. Более того, она во многом совместима с существующей биохимией. Например, липазы и ряд других ферментов в сверхкритическом СО2 работают даже активнее, чем в водной среде, и в биотехнологии это свойство уже нашло применение. Хотя сверхкритический СО2 используется для мягкой стерилизации пищевых продуктов, его антибактериальное действие связано только с растворением клеточных мембран. Ни белки, ни нуклеиновые кислоты в СО2 не страдают. Известны штаммы плесени и бактерий (например, Pseudomonas putida), которые благодаря особому составу липидов устойчивы к некоторым органическим растворителям. Они сохраняют жизнеспособность и в сверхкритическом СО2 (Budisa и Schulze-Makuch, 2014).
Как оказалось, существуют природные микробные сообщества, приспособленные к жизни в жидкой углекислоте. На дне Окинавского желоба (Восточно-Китайское море) были найдены гидротермальные поля, на которых из недр на поверхность дна выходит жидкий СО2. Японские океанологи, исследуя этот район, обнаружили на поле Йонагуни Кнолл IV на глубине 1380 м целое озеро жидкого СО2, скрытого в толще осадков на морском дне (Inagaki et al., 2006). Диаметр озера достигает 200 м, толщина слоя жидкого СО2 – около 30 см, температура – от +3 до +10 °C. В пропитанных СО2 неконсолидированных глинистых осадках над озером обитает разнообразное микробное сообщество с численностью до 1 млрд клеток на 1 см?, которое питается, окисляя идущий снизу метан и сероводород. В толще углекислотного озера есть те же самые микробы, но их численность меньше. Так что среда жидкого СО2 вполне совместима с жизнью, и она может иметь много общего с привычной нам жизнью в водной среде. Если на Земле жидкий СО2 встречается в отдельных местах на глубине, то на более массивной планете («суперземля»), получающей меньше солнечного тепла, возможны океаны жидкого СО2 с небольшой примесью воды на поверхности. Жизнь на такой планете может использовать белки и нуклеиновые кислоты, похожие на земные, но иметь совершенно другие материалы клеточных мембран.
Еще один возможный альтернативный растворитель – формамид (NH2CHO). Этот органический растворитель достаточно безопасен для живых клеток. Он даже используется в смесях для криоконсервации тканей и клеток, так как защищает их мембраны от разрыва ледяными кристаллами. Формамид легко образуется при взаимодействии синильной кислоты с водой. Он остается жидким при температурах от +3 до +220 °C, и по удельной теплоте испарения сравним с водой. Формамид растворяет большинство веществ, растворимых в воде. Как мы помним по предыдущим главам, очень вероятно, что наша земная жизнь делала самые первые шаги не в воде, а в водно-формамидных растворах. Можно себе представить планету, на которой формамид образует не только маленькие лужицы, но и озера, и моря. Жизнь в такой среде может иметь те же азотистые основания, что и у нас, но, скорее всего, другой набор аминокислот и другие клеточные мембраны.
| <<< Назад Выбор химических элементов |
Вперед >>> Альтернативные варианты биохимии на древней Земле. Ксенонуклеиновые кислоты |
- Определение жизни
- Химические свойства биомолекул, которые важны для их функции
- Выбор химических элементов
- Альтернативная биохимия на тех же элементах
- Альтернативные варианты биохимии на древней Земле. Ксенонуклеиновые кислоты
- Треозонуклеиновые и гликоленуклеиновые кислоты
- Пептидо-нуклеиновые кислоты
- Жизнь без полимеров
