Книга: Происхождение жизни. От туманности до клетки
Химические свойства биомолекул, которые важны для их функции
| <<< Назад Определение жизни |
Вперед >>> Выбор химических элементов |
Химические свойства биомолекул, которые важны для их функции
В биохимии широко используется принцип конструктора LEGO. Большие молекулы строятся из мономеров – маленьких кирпичиков, соединенных однотипными связями: белки – из аминокислот, ДНК – из нуклеотидов, полисахариды (целлюлоза, крахмал) – из сахаров. Структура мономера образована прежде всего атомами углерода, соединенными прочными связями C–C. Мономеры между собой связаны менее прочными связями: эфирными (С-О) или пептидными (-СO-NH-). В водной среде разрыв этих связей с участием воды (гидролиз) происходит без затрат энергии, нужен только подходящий катализатор.
С одной стороны, такое устройство позволяет легко разбирать ненужные белки и РНК на мономеры и собирать из них новые белки и РНК без повреждений самих мономеров. С другой стороны, в процессе обмена веществ прочные углерод-углеродные связи внутри аминокислот и нуклеотидов приходится образовывать и разрывать, чтобы создать новые вещества и утилизировать ненужные. Иными словами, основные химические связи в молекулах, составляющих живой организм, должны быть «по умолчанию» достаточно прочными, но должен существовать способ их ослабить, чтобы превращать одни вещества в другие.
В случае нашей земной жизни эти свойства реализованы с помощью углерода, кислорода, азота и водорода. Атомы углерода образуют прочные связи друг с другом и с водородом, поэтому соединения этих двух элементов (углеводороды) химически неактивны. Даже высокоразвитая жизнь с эффективными ферментами с трудом справляется с их расщеплением: лишь немногие бактерии способны питаться углеводородами, например, нефти, поэтому ее разливы и опасны для окружающей среды. Для ослабления связей С-С в биохимии используется, как правило, кислород. Карбонильная группа (С=О) в молекулах придает им химическую активность и позволяет легко создавать и разрушать связи С-С. Если вспомнить, как происходит образование новых и разрыв старых связей C–C в реакциях обмена веществ, то окажется, что почти всегда в этом участвует карбонильная группа. Она есть в составе ацетил-КоА, кетокислотах цикла Кребса и сахарах. Если необходимо соединить или разорвать углерод-углеродную связь там, где этой группы нет, то она сначала будет создана путем окисления, а затем использована для изменения скелета молекулы. Иногда вместо нее применяется иминогруппа (C=NH) с похожими свойствами.
Для хранения и копирования генетической информации очень удобны полимеры, образующие, подобно ДНК, две параллельные[7] цепи, которые обеспечивают избыточность хранения, возможность исправить возникшие повреждения и простой механизм копирования: две цепи разделяются, и на каждой из них собирается новая парная ей цепь. Для генетического полимера желательно, чтобы он принимал линейную форму, а не сворачивался в клубки. ДНК содержит фосфатные группы, которые в воде несут отрицательный электрический заряд. Электростатическое отталкивание этих фосфатных групп способствует поддержанию относительно прямой формы ДНК. Наконец, физические и химические свойства генетической молекулы должны минимально зависеть от ее последовательности, несущей информацию, чтобы не нарушать взаимодействие с системой копирования. Это тоже достигается благодаря электрическому заряду фосфатных групп, распределенных по длине ДНК. Аналог ДНК, в котором фосфаты заменены на незаряженные диметилен-сульфоновые мостики (SNA – sulfone-linked DNA analog), сворачивается в клубки подобно белкам, его свойства (растворимость, способность к реакциям) сильно зависят от последовательности. В обычной ДНК соединение оснований в пары упорядочено тем же электрическим зарядом остова молекулы: остовы двух цепей отталкиваются друг от друга, и поэтому основания могут контактировать друг с другом только одной своей стороной, наиболее далекой от остова. В двухцепочечной форме SNA азотистые основания двух цепей соединяются не только в уотсон-криковские пары (А с Т и Г с Ц), но и множеством других способов, используя любые стороны молекулы, а не только самую дальнюю от остова цепи.
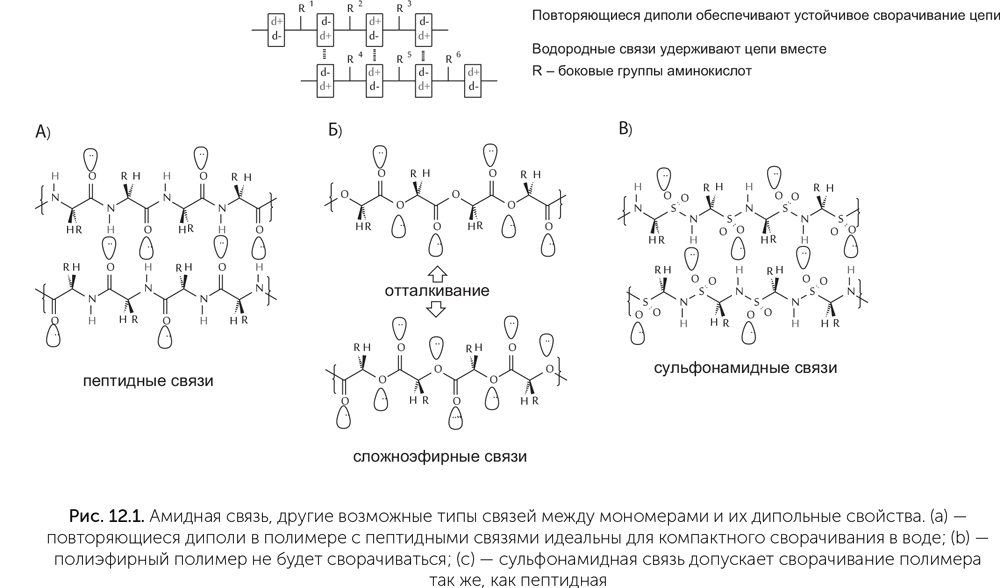
В качестве ферментов в земной жизни используются в основном белки. Есть два самых распространенных способа, с помощью которых разные ферменты ускоряют нужные химические реакции и подавляют побочные. Это связывание реагирующих молекул так, чтобы они контактировали только нужными сторонами, и проведение реакции в «кармане», внутри молекулы фермента, в относительно безводной среде. И то и другое требует, чтобы молекула фермента была определенным образом свернута. Белки идеально подходят для сворачивания, потому что остов белковой цепи лишен глобального электрического заряда. Аминокислоты в белке соединяются пептидными связями (-CO-NH-). Каждая такая связь несет небольшой отрицательный заряд на кислороде и небольшой положительный – на водороде, т. е. является диполем[8]. Благодаря притяжению между диполями белки образуют свернутые структуры, такие как альфа-спираль и бета-слой (подробнее в главе 13). Другие типы связи между мономерами, например эфирная С-О-С, не обладают дипольными свойствами. Возможны только два аналога пептидной связи с аналогичными дипольными свойствами – сульфонамидная (-SO2-NH-) и фосфонамидная связь (-HPO2-NH-) (рис. 12.1).
Всякий раз, когда мы задаем вопросы «Почему так?» и «Почему бы не по-другому?» об устройстве живых систем, возможны три группы ответов. Во-первых, выбор одного варианта из нескольких возможных может быть функциональным: жизнь пробовала разные варианты, и самый выгодный вытеснил все прочие. Во-вторых, выбор мог быть результатом исторической случайности: пространство вариантов устройства молекул очень велико (только для небольшого белка из 100 аминокислот возможны 20100 вариантов последовательности – это гораздо больше, чем атомов во Вселенной), и жизнь, что очевидно, не могла перепробовать все возможные варианты. В-третьих, выбор может быть рудиментарным: когда-то давно он был функциональным и лучше всего подходил для решения какой-то проблемы, которая давно уже неактуальна, а потом менять что-либо было уже поздно.
Можно проиллюстрировать три типа приведенных ответов на примере выбора азотистых оснований. Пара А-Т связана слабее, чем G-C (две водородных связи, а не три). Если заменить аденин на аминоаденин, то пара аА-Т будет тоже иметь три водородные связи. Такая замена позволила бы повысить точность копирования ДНК. Однако аминоаденин в ДНК не используется. Возможное функциональное объяснение: для оптимальной работы генома нужен выбор между сильными и слабыми связями в парах нуклеотидов. Рудиментарное объяснение: аденин устойчив к ультрафиолетовому излучению. В современных клетках это свойство аденина больше не важно, но менять аденин на другие молекулы уже слишком сложно. Объяснение путем исторической случайности: аденин легко образуется абиогенно из цианида или формамида, в отличие от аминоаденина, поэтому генетические механизмы сформировались раньше, чем появилась возможность попробовать аминоаденин.
Во всех случаях, когда мы спрашиваем «Почему бы не по-другому?», полезно пытаться придумать все три типа ответов, даже если мы не можем экспериментально их проверить.
| <<< Назад Определение жизни |
Вперед >>> Выбор химических элементов |
- Определение жизни
- Химические свойства биомолекул, которые важны для их функции
- Выбор химических элементов
- Альтернативная биохимия на тех же элементах
- Альтернативные варианты биохимии на древней Земле. Ксенонуклеиновые кислоты
- Треозонуклеиновые и гликоленуклеиновые кислоты
- Пептидо-нуклеиновые кислоты
- Жизнь без полимеров
- Выбор химических элементов
- Экологические функции биосферы и почвы
- Географические законы и некоторые факторы среды
- Глава 10 Поведение и некоторые диетические факторы
- „БУЛЬДОГИ", КОТОРЫЕ-МУРАВЬИ, И „БАРХАТНЫЕ МУРАВЬИ", КОТОРЫЕ — ОСЫ
- Бандикуты, которые не бандикуты
- Функции мира живых организмов
- 4.1.3. Некоторые специфические приспособления гидробионтов
- Три функции личности
- Гены, которые мы потеряли
- 1. Особенности строения бактериальной клетки. Основные органеллы и их функции
- Некоторые проблемы, связанные со стереоскопическим зрением
