Книга: Энергия жизни. От искры до фотосинтеза
Глава 8. ТЕПЛО И ХИМИЧЕСКИЕ РЕАКЦИИ
| <<< Назад Глава 7. ЧАСТИЦЫ, УДЕРЖИВАЕМЫЕ ВМЕСТЕ |
Вперед >>> Глава 9. НАПРАВЛЕНИЕ РЕАКЦИИ |
Разделы на этой странице:
- Рис. 8. Калориметр с бомбой
- 2Н2 + O2 ? 2H2O
- Рис. 9. Реакция соединения водорода и кислорода при постоянном давлении и при постоянном объеме
- С + O2 ? CO2.
- С + O2 ? СO2 + 94,03 ккал.
- С + O2 ? CO2
- 2Н2 + O2 ? 2H2O,Н2 + 1/2O2 ? H2O,
- Н2 + 1/2O2 ? H2O,
- СН4 + 2O2 ? СO2 + 2H2O
- С2H6O + 3O2 ? 2СO2 + 3H2O
- НСl + NaOH ? NaCl + H2O
- Н2 + 1/2O2 ? H2O,
- H2O ? Н2 + 1/2O2,
- Рис. 10. Механическая энергия и химическая энергия
- C + 1/2O2 ? CO
- CO + 1/2O2 ? CO2,
- С + 1/2О2 + СО + 1/2О2 ? СО + СО2
- С + О2 ? СО2
- 1) С2Н4 + 3O2 ? 2СO2 + 2H2O
- 2) С + O2 ? CO2
- 3) Н2 + 1/2О2 ? Н2О
- 4) Н2 ? H2O — 1/2O2
- 5) 2Н2 ? 2H2O — O2
- 6) 2С ? 2CO2 — 2O2
- 7) 2СO2 + 2H2O ? С2Н4 + 3O2
- 8) Ноль ? С2Н4 + 3O2 — 2СO2 — 2H2O
- 9) 2Н2 + 2С ? 2H2O — O2 + 2СO2 —— 2O2 + С2Н4 + 3O2 — 2СO2 — 2H2O
- 10) 2Н2 + 2С ? С2Н4
Глава 8.
ТЕПЛО И ХИМИЧЕСКИЕ РЕАКЦИИ
Способа напрямую измерить химическую энергию не существует, но тепловую энергию измерить несложно. Предположим, что некоторую реакцию проводят в замкнутой камере, запуская ее, скажем, через электрический провод. Со всех сторон камера омывается определенным количеством воды, которая тщательно перемешивается. Вся система «камера плюс вода» изолирована во избежание теплообмена с окружающей средой.
Предположим, что в камере электрический ток поджигает смесь водорода с кислородом. В результате происходит вспышка и образуется вода. Химическая энергия, представленная связями между атомами водорода и кислорода в молекулах соответствующих газов, больше, чем представленная связями в молекуле воды. Поэтому при переходе от кислорода и водорода к воде химическая энергия теряется. Но эта потеря химической энергии строго уравновешивается выработкой равного количества энергии в форме тепла.
Когда в камере появляется это тепло, температура окружающей камеру воды повышается. Перемешивание воды обеспечивает ее равномерный и как можно более быстрый прогрев. Изоляция системы гарантирует, что повышение температуры воды происходит исключительно за счет повышения температуры в камере.
Измерение повышения температуры заранее известного объема воды позволяет подсчитать количество калорий тепла, вырабатываемого в ходе реакции («теплоту реакции»), что автоматически свидетельствует об аналогичном изменении в содержании химической энергии. Строго говоря, при обычной реакции горения не вся вырабатываемая в ее ходе энергия уходит в тепло, поскольку, как правило, кроме тепла вырабатывается еще и значительное количество света. Однако в замкнутой камере любой вырабатываемый свет быстро поглощается стенами и переводится в тепло. Есть крайне малая вероятность того, что реакции будет сопутствовать увеличение химической энергии, и тогда для уравновешивания этих изменений должно будет исчезнуть эквивалентное количество тепла, и, следовательно, температура окружающей камеру воды понизится.
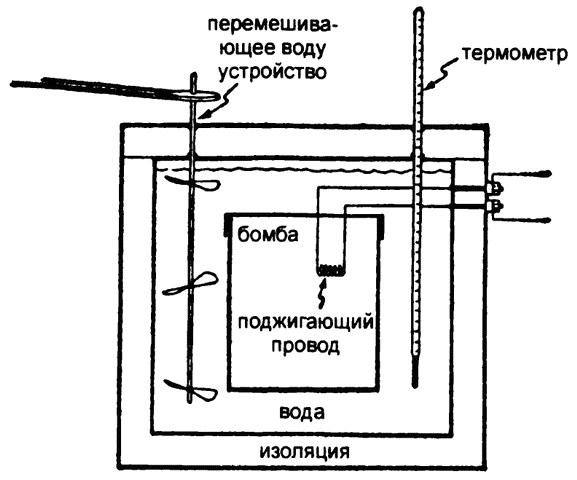
Рис. 8. Калориметр с бомбой
Такую камеру называют калориметром (от латинских слов «тепло» и «мерить»), а исследования, проводимые с ее использованием, — калориметрическими. Реакции, производимые в камере калориметра, обычно происходят со скоростью взрыва, поэтому саму камеру иногда называют «бомбой» (рис. 8).
История современных способов калориметрии началась с экспериментов датского химика Юлиуса Томсена и французского физика Пьера Эжена Марселена Бертло, которые произвели сотни калориметрических измерений во второй половине XIX века.
Измеряя теплоту реакций превращения смеси водорода и кислорода в воду, невозможно установить абсолютное количество химической энергии, присутствующей в смеси водорода и кислорода, или в воде. Можно измерить лишь разницу химических энергий до и после реакции — разность уровней химической энергии воды и смеси водорода и кислорода. Но только эта разность и может представлять практический интерес для химика, поскольку, согласно второму закону термодинамики, количество работы, которое можно извлечь из химической реакции, зависит только от разности уровней химической энергии, так же как и количество работы, которое можно извлечь из тепловой машины, зависит только от разности уровней тепловой энергии (то есть температур).
В физике и математике любую разность часто представляют греческой буквой «дельта» (?) перед самим значением. Таким образом, если мы обозначаем энергию буквой Е, то разность энергий будет обозначаться как ?Е, что читается как «дельта Е». Применительно к реакции получения воды из водорода и кислорода, ?Е может представлять как потерю химической энергии во время этого процесса, так и получение тепловой. Естественно, в обоих этих случаях она будет иметь одно и то же значение.
Однако измерение теплоты реакции можно проводить двумя способами. Вещества, вступающие в химическую реакцию, можно брать в определенных количествах, как это делается в калориметрах. Объем бомбы калориметра в ходе реакции не меняется. Если в результате реакции увеличивается количество газа (а калориметрические эксперименты проводят чаще всего именно с газами или парами), занимаемый им объем все равно остается прежним и соответственно давление возрастает. И если количество газа уменьшается, объем все равно остается прежним и давление падает. Обозначение ?Е специально относится к изменению энергии именно в данных условиях сохранного объема и переменного давления. (Иногда используется обозначение ?U, но я буду придерживаться ?Е.)
С другой стороны, можно представить себе и ситуацию, когда реакция проводится в сосуде, верх которого представляет собой поршень, способный сдвигаться вверх и вниз без трения, герметично прилегая при этом к стенкам сосуда. В таком сосуде давление меняться не будет, поскольку оно всегда будет оставаться ровно таким, чтобы держать вес поршня. При возрастании давления поршень будет двигаться вверх, пока объем той части сосуда, где произошла реакция, не вырастет настолько, что давление опять приобретет прежнее значение. Если же давление упадет, то и поршень двинется вниз, что приведет к уменьшению объема и увеличению давления до уравновешивающего значения. В таких условиях, независимо от того, как меняется в ходе реакции количество газа, давление останется неизменным, а меняться будет только объем. Тогда реакция будет происходить при постоянном давлении и переменном объеме.
Один моль любого газа при нормальном атмосферном давлении занимает всегда один и тот же объем (22,4 литра), поскольку размер молекул не влияет на их количество в заданном объеме. В реакции водорода и кислорода
2Н2 + O2 ? 2H2O
2 моля водорода соединяются с 1 молем кислорода для образования 2 молей воды (разумеется, при той температуре, при которой происходит эта реакция, вода образуется в единственно возможной форме — газообразной, то есть получается водяной пар). Иначе говоря, на входе реакция имеет 3 моля газов, а на выходе — только 2. (Разумеется, масса участвующего в реакции вещества не меняется; просто в воде атомы сгруппированы плотнее, чем в водороде и кислороде.)

Рис. 9. Реакция соединения водорода и кислорода при постоянном давлении и при постоянном объеме
В камере с поршнем это уменьшение объема тут же вызовет втягивание поршня, и давление восстановится на прежнем уровне. В бомбе калориметра, где объем уменьшиться не может, вместо этого на треть уменьшится давление (возможно, это проще понять, рассмотрев рис. 9).
В первом и во втором случаях будет зафиксировано разное количество изменения энергии. При постоянном давлении оно будет больше, чем при постоянном объеме. Символ, которым обозначают изменение энергии при постоянном давлении, — ?Н, где Н — тепловое содержание, иначе именуемое «энтальпия». Таким образом, для нашей конкретной реакции ?Н больше, чем ?Е. Это отношение можно выразить и математически, и одно можно без проблем вывести из другого.
В природе химические реакции происходят обычно при постоянном давлении — это атмосферное давление, и оно практически всегда одинаково. Поэтому из двух названных нами величин больше практической ценности имеет ?Н, и получаемую с помощью калориметра ?Е переводят в ?Н.
Возникает вопрос и о том, для какого количества материала подсчитывается ?Н. Очевидно, что если в кислороде сжечь 10 граммов водорода, то будет произведено в десять раз больше тепла, чем если сжечь 1 грамм. Более того, каким образом сравнивать тепло от сжигания водорода с теплом от сжигания углерода? Если сжечь для сравнения по грамму того и другого, то как учесть при этом тот факт, что 1 грамм водорода содержит в двенадцать раз больше атомов, чем 1 грамм углерода?
Химики решили, что полезнее всего с практической точки зрения определять тепло реакции на молярной основе, то есть сравнивать теплоту реакции 1 моля водорода, сжигаемого в кислороде, с теплотой реакции 1 моля опять же сжигаемого в кислороде углерода. Тогда веса участвующих в реакции веществ будут разными, но количество молекул — одинаковым, а это важнее.
Поэтому ?Н, как правило, принято понимать как «молярную теплоту реакции при постоянном давлении». Это та величина, на которую изменяется тепловое содержание 1 моля интересующего нас вещества при его вступлении в реакцию.
Вернемся к примерам. Вот еще одно соединение — углерода и кислорода:
С + O2 ? CO2.
Молярная теплота данной реакции — 94,03 килокалории. Поэтому для полноты уравнения это значение тоже следует указать в выражении, поскольку в полном значении этого слова соединение углерода и кислорода производит не только углекислоту, но и энергию в виде света и тепла. Поэтому в полном виде наше выражение будет выглядеть так:
С + O2 ? СO2 + 94,03 ккал.
Это можно прочесть так: 1 моль углерода плюс 1 моль кислорода производят 1 моль углекислоты плюс 94,03 килокалории. Или так (что то же самое): 12 граммов углерода плюс 32 грамма кислорода производят 44 грамма углекислоты плюс 94,03 килокалории.
Чаще же теплоту реакции не вписывают в само уравнение, а указывают сбоку, как отдельный параметр, таким образом:
С + O2 ? CO2
?Н = -94,03 ккал.
Обратите внимание, что значение ?Н в данном случае приведено как отрицательная величина. Дело в том, что при соединении углерода с кислородом химическая энергия системы уменьшается, а тепловая — увеличивается. Если рассматривать этот процесс с точки зрения химической энергии, то изменения в энергетическом содержании покажутся отрицательными, а если с точки зрения тепловой — то положительными. Количество энергии, естественно, остается неизменным, независимо от точки зрения, при условии, что в процессе рассмотрения различных реакций сама точка зрения тоже остается неизменной. В течение некоторого периода одни химики расценивали изменения в энергии, при которых отдается тепло, как положительные, а другие — как отрицательные. В результате получалась путаница, и сейчас решено в этом случае использовать всегда отрицательное значение.
Далее, рассмотрим процесс горения водорода. Этот процесс можно, как я уже говорил, описать двумя способами, каждый из которых будет уравновешенным:
2Н2 + O2 ? 2H2O,
Н2 + 1/2O2 ? H2O,
Химиков интересует, как правило, тепло, вырабатываемое при сжигании 1 моля водорода, так что второе выражение, при котором используется 1 моль водорода, является для них предпочтительным. (Для любых же других химических целей, за исключением подсчета теплоты реакции, предпочтительным является первое выражение.)
Итак, идем дальше: данные калориметрических измерений позволяют нам написать
Н2 + 1/2O2 ? H2O,
?Н = -68,37 ккал.
Это то значение теплоты реакции, которое получается, если дать получаемой воде остыть до жидкого состояния, иначе говоря, в нее включается и отдаваемая при остывании латентная теплота парообразования. Если же вода остается в газообразном состоянии, то без латентной теплоты парообразования ?Н становится равной только -57,8 килокалории. Однако такого рода уточнения, как бы важны они ни были для химиков, для нас сейчас не будут представлять особого интереса.
Сравнивая теплоту реакции горения углерода с теплотой реакции горения водорода, мы сравниваем их моль к молю. Один моль горящего углерода отдает почти в два раза меньше тепла, чем 1 моль горящего водорода. Но моль углерода весит 12 граммов, а моль водорода — всего 2 грамма. Если мы будем сравнивать эти вещества грамм к грамму, мы увидим, что 1 грамм углерода при сжигании отдает 94,03/12, то есть 7,8 килокалории, а грамм водорода — 68,37/2, то есть 34,2 килокалории. Соответственно при весовом подходе (который является естественным для всех, кроме химиков) логично сделать вывод, что при сжигании водорода вырабатывается почти в 41/2 раза больше энергии, чем при сжигании углерода. Так что всегда важно знать, что именно предстоит сравнивать.
Уголь представляет собой практически чистый углерод, а водород — он и есть водород. Однако существуют важные виды топлива, молекулы которых содержат более одного вида элементов. В состав молекул различного вида нефтепродуктов — бензина, керосина, дизельного топлива — входят и водород, и углерод. В состав древесины входят молекулы, содержащие и углерод, и водород, и кислород. Такие молекулы, хоть и гораздо более сложны, подчиняются тем же самым законам. Возьмем для примера метан, основную составляющую так называемого «природного газа», используемого в газовых плитах и газовом отоплении. Молекула метана состоит из 1 атома углерода и 4 атомов водорода (СН4). Вот так выглядит выражение, описывающее соединение метана с кислородом:
СН4 + 2O2 ? СO2 + 2H2O
?Н — -210,8 ккал.
Как видно из формулы, при этом образуются и углекислота, и вода.
Если оценивать молярно, то метан способен вырабатывать больше тепла, чем и углерод, и водород по отдельности. Однако молекулярный вес метана — 16 складывается из 12 — веса атома углерода и 4 — веса 4 атомов водорода. Соответственно 1 грамм метана выделяет при горении 210,8/16, то есть 13,2 килокалории. Это больше, чем тепло, высвобождаемое при горении 1 грамма углерода, но меньше, чем тепло, высвобождаемое при горении 1 грамма водорода. Собственно, этого и следовало ожидать от вещества, состоящего частично из углерода, частично из водорода.
Пример еще более сложной молекулы — этиловый спирт (известное вещество, присутствующее в пиве, вине и виски и других алкогольных напитках). Его молекула состоит из 2 атомов углерода, 6 атомов водорода и 1 атома кислорода (С2H6O).
Так выглядит выражение для реакции его горения:
С2H6O + 3O2 ? 2СO2 + 3H2O
?Н = —327,6 ккал.
Молекулярный вес этилового спирта — 46 (24 — 2 атома углерода, 6 — 6 атомов водорода, 16 — 1 атом кислорода), так что при сгорании 1 грамма этилового спирта высвобождается 3276/46, то есть 7,1 килокалории. Это гораздо меньше, чем при сгорании грамма водорода или метана. Это даже меньше, чем при сгорании 1 грамма углерода. Дело в том, что в молекуле спирта уже имеется 1 атом кислорода, поэтому такую молекулу можно рассматривать, так сказать, как уже частично сгоревшую. Один из 7 атомов кислорода, необходимых для связывания всех имеющихся атомов углерода и водорода в углекислоты и воду, уже присутствует в молекуле.
Участие в реакции кислорода не является обязательным условием выделения при ней тепла (хотя именно реакции такого плана с участием кислорода стали первыми известными человечеству). На самом деле любые химические изменения имеют некоторую теплоту реакции. К примеру, в предыдущей главе уже приводились выражения для реакции формирования хлороводорода из водорода и хлора и хлорида натрия — из натрия и хлора.
?Н первой из этих реакций 22,6 килокалории (для создания 1 моля хлороводорода из половины моля водорода и половины моля хлора), а второй 98,3 килокалории (для создания 1 моля хлорида натрия из 1 моля натрия и половины моля хлора).
Существует такой тип веществ, как кислоты, характеризующийся определенным набором свойств, который может вступать в реакцию с другим типом веществ, так называемыми основаниями, обладающими свойствами прямо противоположными кислотным. В результате этих реакций образуются вещества, чьи свойства не близки ни кислотам, ни основаниям. Такие реакции называются «реакциями нейтрализации», и мы приведем пример одной из них. Вот как реагирует хлороводород, раствор которого имеет кислотные свойства, с гидроксидом натрия, раствор которого является основанием (в результате реакции получаются хлорид натрия и вода):
НСl + NaOH ? NaCl + H2O
?Н = -137,4 ккал.
Даже такие процессы, которые химическими можно назвать лишь с некоторой натяжкой, например растворение некоего вещества в воде, могут выделять тепло реакции. Это вполне логично, поскольку при растворении вещества происходит замена сил, удерживающих его молекулы вместе, на силы, удерживающие его молекулы посреди молекул воды. Так, если в воде растворить карбонат натрия (пищевую соду), то ?Н этого процесса (именуемого в данном случае «молярной теплотой растворения», а не «молярной теплотой реакции») составит около -5,64 килокалории.
Остановимся поподробнее на карбонате натрия. Формула этого вещества — Na2CO3, молекулярный вес — 106 (46 — вес 2 атомов натрия, 12 — вес углерода и 48 — вес 3 атомов кислорода), так что растворение 1 грамма карбоната натрия приведет к выделению 564/106, то есть 0,053 килокалории. Это 53 калории, то есть меньше тепла, чем выделится при замерзании 1 грамма воды, так что неудивительно, что факт выделения тепла при растворении соды остается незамеченным.
Изменения химической энергии не должны нарушать законы термодинамики. Я уже упоминал об этом, когда подчеркивал, что изменение уровня химической энергии должно компенсироваться противоположным изменением уровня тепловой энергии, чтобы не оказался нарушенным первый закон термодинамики. Но это еще не все.
Самый первый закон о свойствах химической энергии вывели в свое время Лавуазье и другой французский ученый, Пьер Симон де Лаплас, который в 1780 году на основании достаточно грубых (по позднейшим меркам) измерений сделал вывод, что тепло, поглощаемое при разложении вещества на составляющие, равняется теплу, затрачиваемому на то, чтобы создать это же вещество из этих же составляющих.
Вот пример. Я уже говорил, что при соединении водорода и кислорода выделяется 68,37 килокалории тепла на моль сгоревшего водорода, или (что то же самое, как видно из уравнения) на моль получившейся воды:
Н2 + 1/2O2 ? H2O,
?Н = -68,37 ккал.
Следовательно, согласно закону Лавуазье—Лапласа, разложение 1 моля воды на водород и кислород (выражение для этого действия можно получить, просто обратив вспять выражение для создания воды из составляющих) потребует приложения 68,37 килокалории энергии, то есть
H2O ? Н2 + 1/2O2,
?Н = +68,37 ккал.
В данном случае значение ?Н положительно, поскольку вода в ходе реакции получает, а не отдает химическую энергию за счет того, что для того, чтобы реакция разложения молекулы воды оказалась возможной, к ней прилагают энергию тепловую или (что чаще) электрическую.
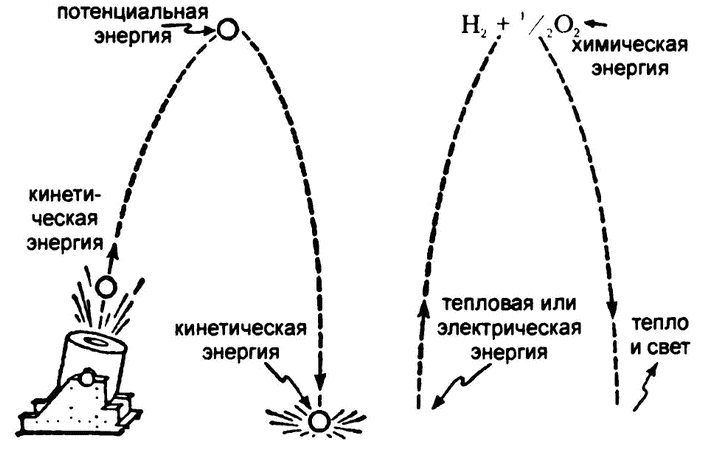
Рис. 10. Механическая энергия и химическая энергия
Можно провести аналогию между химической энергией и механической. В механике кинетическая энергия движущегося вверх предмета полностью преобразуется в потенциальную энергию в верхней точке подъема, а затем — обратно в изначальную кинетическую энергию в нижней точке падения. Точно таким же образом нехимическая энергия, которую получает вода, переводится в химическую путем распада на смесь водорода с кислородом, а затем вновь переходит в нехимическую, когда водород с кислородом снова соединяются, образуя воду (рис. 10).
Разумеется, полное равенство достижимо только в идеальных условиях. В отношении механической энергии — это отсутствие трения и сопротивления воздуха, в отношении химической — это отсутствие теплопотери. В реальности, когда воду разлагают с помощью электрического тока, часть электрической энергии всегда теряется, переходя в тепло; а если энергию сразу подают в воду в тепловом виде, то часть ее обязательно уходит в окружающее пространство. В любом случае сначала приходится тратить больше энергии, чем ее удастся получить в итоге. Однако это лишь отражение увеличения энтропии, а в целом же данный факт только лишний раз подтверждает, что в отношении химической энергии законы термодинамики соблюдаются так же, как и а отношении любой другой.
Еще один важный закон открыл в 1840 году физик по имени Герман Иванович Гесс в Санкт-Петербурге (Россия). Проведя множество экспериментов в области теплоты реакций, он сделал вывод, что в общем случае, если реакция происходит в несколько стадий, то общий объем теплоты реакций в цепочке будет тот же, что и в том случае, если производить реакцию в один прием. Этот закон был назван именем открывшего его ученого и оказался столь важным, что Гесса сейчас принято считать отцом термохимии (тепловой химии).
В качестве простого примера (хоть и не попавшего в число тех, что наблюдал сам Гесс) можно привести опять же горение углерода. Углерод может соединяться с кислородом и в пропорции атомов 1:1 — в таком случае получается угарный газ, СО. Соответственно мы можем написать такое выражение:
C + 1/2O2 ? CO
?Н = -26,4 ккал.
Угарный газ способен гореть, то есть объединяться еще с одним атомом кислорода в более распространенный углекислый газ:
CO + 1/2O2 ? CO2,
?Н = -67,6 ккал.
Если мы сложим оба этих выражения (как будто бы это были просто математические уравнения), то по закону Гесса мы должны будем получить суммарную теплоту реакции.
С + 1/2О2 + СО + 1/2О2 ? СО + СО2
?Н = (-26,4) + (-67,6) ккал.
Преобразовав получившееся выражение опять же по законам математики, то есть сократив находящийся по обе стороны уравнения СО и сложив две половинки молекулы кислорода в одну целую, мы получаем
С + О2 ? СО2
?Н = -94 ккал,
то есть именно то же самое выражение, которое мы вывели бы, если бы просто сжигали углерод, получая при этом в один прием углекислоту.
Более общая формулировка закона Гесса звучит так: при преобразовании химическим образом вещества А в вещество В итоговое изменение энергетического содержания будет одним и тем же, независимо от того, каким путем вещество было преобразовано. Здесь можно снова провести аналогию с механической энергией, где совершенно не важно, каким образом и по какому маршруту тело было перемещено из одного положения в другое; на изменение его потенциальной энергии влияет только само изменение положения.
Должен признаться, что, приведя в качестве самого простого примера действия закона Гесса процесс горения углерода, я несколько погрешил против истины. Измерить напрямую количество тепла, получаемого при сжигании углерода с образованием угарного газа, невозможно, поскольку нельзя построить эксперимент таким образом, чтобы углерод, соединяясь с кислородом, образовывал только угарный газ. Чистый угарный газ можно получать, но по-другому.
Однако термохимик способен произвести из углерода углекислоту и измерить теплоту этой реакции (получится -94 килокалории). Может он и путем сжигания сделать из угарного газа углекислый, снова измерив при этом теплоту реакции (получится -67,6 килокалории). Затем, положившись на закон Гесса, он вычтет из первой теплоты реакции вторую и сделает вывод, что молярная теплота реакции перевода углерода в моноксид углерода, угарный газ, составит -26,4 килокалории, хотя доказать это экспериментально ученый окажется не в состоянии.
Важность закона Гесса заключается в том, что он означает следующее: теплоту любой реакции, даже той, которую по каким-то причинам невозможно измерить, можно высчитать исходя из теплоты других, более доступных для экспериментатора реакций.
Например, существует такой углеводород, как этилен, — это газ, молекулы которого состоят из 2 атомов углерода и 4 — водорода (С2Н4). Один моль этого газа, сгорая в кислороде, выделяет 340 килокалорий. Выражение для этой реакции выглядит так (я пронумерую выражения для удобства отсылки к ним в дальнейшем):
1) С2Н4 + 3O2 ? 2СO2 + 2H2O
?Н = -340 ккал.
Я уже описывал процессы горения углерода и водорода, но сейчас я снова выпишу выражения для этих реакций, потому что они нам понадобятся:
2) С + O2 ? CO2
?Н = -94 ккал.
3) Н2 + 1/2О2 ? Н2О
?Н = -68 ккал.
Теперь давайте проведем математические преобразования этих химических выражений. Если вы из тех, кого тошнит от математики, то можете смело пролистнуть остаток этой главы; остальным же, думаю, должно понравиться.
В выражении 3 перенесем 1/2O2 из левой части уравнения в правую с переменой знака (на теплоте реакции это никак не скажется), получим:
4) Н2 ? H2O — 1/2O2
?Н = -68 ккал.
Теперь удвоим обе части выражения 4, при этом удвоится и теплота реакции:
5) 2Н2 ? 2H2O — O2
?Н = -136 ккал.
Сделаем то же самое с выражением 2 — переместим O2 в правую часть уравнения с переменой знака и удвоим все значения, включая теплоту реакции:
6) 2С ? 2CO2 — 2O2
?Н = -188 ккал.
Обратим выражение 1 без перемены знаков; в этом случае, согласно закону Лавуазье—Лапласа, изменится знак у теплоты реакции:
7) 2СO2 + 2H2O ? С2Н4 + 3O2
?Н = +340 ккал.
В выражении 7 переместим 2СO2 и 2H2O в правую часть с переменой знака — знак теплоты реакции останется при этом неизменным:
8) Ноль ? С2Н4 + 3O2 — 2СO2 — 2H2O
?Н = +340 ккал.
(Я написал здесь «ноль» вместо 0, чтобы его не путали с обозначением кислорода — О.)
Теперь же давайте сложим выражения 5, 6 и 8, не забывая складывать и значения теплоты реакций. Мы получим следующий результат:
9) 2Н2 + 2С ? 2H2O — O2 + 2СO2 —
— 2O2 + С2Н4 + 3O2 — 2СO2 — 2H2O
?Н = (-136) + (-188) + (+340) ккал.
Проведя все возможные математические сокращения правой части, мы увидим, что сократилось все, кроме С2Н4, так что все выражение теперь сводится к
10) 2Н2 + 2С ? С2Н4
?Н = +15,2 ккал.
Таким образом, мы обнаружили, что если мы хотим 2 моля водорода заставить вступить в соединение с 2 молями углерода для получения 1 моля этилена, то для того, чтобы реакция состоялась, необходимо затратить 15,2 килокалории энергии. Иными словами, 1 моль этилена содержит на 15,2 килокалории больше химической энергии, чем составляющие его углерод и водород. Или можно сказать так: молярное тепло формирования этилена равняется + 15,2 килокалории.
На самом деле напрямую измерить это тепло формирования невозможно, поскольку не существует такой химической реакции, в ходе которой можно было бы за один шаг создать этилен из углерода и водорода. Тем не менее вышеприведенная цифра не вызывает у химиков никаких сомнений. Во-первых, все математические действия, произведенные нами, обоснованы вторым законом термодинамики, которые не оспаривает никто из химиков, а во-вторых, во всех тех случаях, где математические расчеты можно проверить практикой, они подтверждаются.
По этим причинам теплота формирования этилена и многих других соединений рассчитывается на бумаге ко всеобщему удовлетворению, и тот факт, что получаемые значения не проверены на практике и никогда не будут проверены, никого не смущает.
| <<< Назад Глава 7. ЧАСТИЦЫ, УДЕРЖИВАЕМЫЕ ВМЕСТЕ |
Вперед >>> Глава 9. НАПРАВЛЕНИЕ РЕАКЦИИ |
- Глава 1. УСИЛИЯ, КОТОРЫЕ МЫ СОВЕРШАЕМ
- Глава 2. ПЛОДЫ ОГНЯ
- Глава 3. ИЗМЕРЯЕМОЕ ДВИЖЕНИЕ
- Глава 4. ИЗМЕРЯЕМОЕ ТЕПЛО
- Глава 5. ТЕПЛОВЫЕ ПОТОКИ
- Глава 6. ДВИЖУЩИЕСЯ ЧАСТИЦЫ
- Глава 7. ЧАСТИЦЫ, УДЕРЖИВАЕМЫЕ ВМЕСТЕ
- Глава 8. ТЕПЛО И ХИМИЧЕСКИЕ РЕАКЦИИ
- Глава 9. НАПРАВЛЕНИЕ РЕАКЦИИ
- Глава 10. ЭЛЕКТРИЧЕСКИЙ ПУТЬ
- Глава 11. КАК ПОДТОЛКНУТЬ РЕАКЦИЮ
- Глава 12. СТИМУЛЯЦИЯ БЕЗ ПРИЛОЖЕНИЯ ЭНЕРГИИ
- § 50 Химические реакции
- 6. НЕОБЫЧНЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ. ХИМИЧЕСКИЕ КУРЬЕЗЫ
- Глава 8. ТЕПЛО И ХИМИЧЕСКИЕ РЕАКЦИИ
- 2. Аллергические реакции. Особенности инфекционной аллергии
- Тип стрессорной реакции – А или Б – генетически детерминирован
- Результат выработки реакции избегания незнакомых людей
- Устойчивость к стрессорным ситуациям – это скорость угасания стрессорной реакции
- Скорость угасания реакции
- Эндокринные реакции после неконтролируемого стресса у представителей типа А и Б
- Метод выработки реакции избегания незнакомых людей и домашних животных
- 3.6. Изменчивость признаков у организмов: модификационная, мутационная, комбинативная. Виды мутаций и их причины. Значен...
- Химические элементы и вещества
