Книга: Происхождение жизни. От туманности до клетки
Происхождение цитохромных комплексов bc1 (комплекс III) и b6f
| <<< Назад Происхождение комплекса I (НАДН-хинон-оксидоредуктаза) |
Вперед >>> Происхождение цитохром-с-оксидазы |
Происхождение цитохромных комплексов bc1 (комплекс III) и b6f
Цитохромные комплексы bc1 и b6f входят в состав электрон-транспортных цепей митохондрий, хлоропластов, цианобактерий и многих аэробных бактерий. Как можно догадаться из их названия, они состоят из нескольких цитохромов разных типов. Цитохромные комплексы переносят электроны с хинонов на водорастворимые высокопотенциальные переносчики, обычно малые цитохромы с или пластоцианины. Важной функцией этих комплексов является бифуркация, или разветвление пути электронов (процесс, обратный конфуркации электронов в комплексе Qmo сульфатного дыхания). Приняв два электрона с хинона на наружной стороне мембраны и выбросив наружу два протона, цитохромный комплекс пускает их по разным путям. Один электрон проходит к сайту растворимого переносчика (например, цитохрома с) и следует дальше по электрон-транспортной цепи, а другой электрон попадает на внутреннюю сторону мембраны, где находится второй хинонный сайт комплекса bc1. Когда хинон во втором сайте примет два электрона, он проходит через мембрану к первому хинонному сайту комплекса и отдает там электроны на цитохром и протоны в воду. За счет такого сложного пути электронов удается полнее использовать разницу потенциалов между хиноном и цитохромом с: на каждый прошедший через комплекс электрон через мембрану переносятся два протона, а не один, как в простейшем Q-цикле.
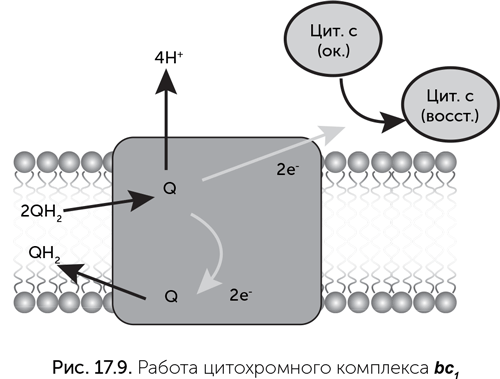
Цитохромные комплексы bc1 содержат от 3 субъединиц у ряда бактерий до 11 субъединиц в митохондриях. Три основные субъединицы, которые есть в любых вариантах комплекса bc1, – это трансмембранный цитохром b (8 трансмембранных спиралей, два гема b), цитохром с и железосерный белок Риске. Последний содержит необычный железосерный кластер 2Fe-2S, связанный с двумя цистеинами и двумя гистидинами. Из-за такого аминокислотного окружения его редокс-потенциал гораздо выше, чем у ферредоксинов, в которых железосерные кластеры связаны с белком через четыре цистеина. Комплексы b6 f устроены сходно с bc1, но вместо одного цитохрома b в них есть два разных белка: цитохром b6 с четырьмя трансмембранными спиралями и белок PetD с тремя спиралями. Они по последовательности аминокислот сходны с N– и C-концевыми половинами цитохрома b комплекса bc1, но связывают больше кофакторов: два гема b на цитохроме b6 и по одной молекуле гема с, хлорофилла а и каротина на белке PetD. Цитохром f функционально аналогичен цитохрому c1 комплекса bc1 и тоже содержит гем c, но совсем не похож на цитохром c1 по последовательности и имеет другое происхождение. Белки Риске комплексов bc1 и b6f устроены практически одинаково.
История цитохромных комплексов запутана из-за горизонтальных переносов генов. Комплексы bc1-типа (с длинным цитохромом b) встречаются как у бактерий, так и у архей, а комплексы типа b6f – только у бактерий. У некоторых бактерий в геноме закодировано до четырех разных комплексов, причем на филогенетическом дереве они находятся на различных ветвях. В одном геноме могут сочетаться гены комплексов bc1 и b6f. Лишь недавно, с накоплением данных по большому количеству геномов, удалось установить, что на филогенетическом дереве есть несколько ветвей bc1 комплексов и несколько ветвей b6f комплексов (Dibrova et al., 2013). Иными словами, переход от одного типа к другому – будь то слияние двух генов в один длинный цитохром b или разделение гена на два – происходил несколько раз. Это позволяет предположить вероятное направление эволюции: несколько независимых событий разделения гена в одной и той же точке, да еще с последующим появлением сайта связывания гема c в одном месте в разных ветвях комплексов b6f очень маловероятны. А эволюция в обратном направлении – слияние двух соседних генов одного оперона и утрата сайта связывания гема с – вполне могла происходить много раз независимо.
Длинная 8-спиральная форма цитохрома b уникальна для комплекса bc1. Короткие 4-спиральные цитохромы b встречаются, помимо комплекса b6f, еще в ряде мембранных окислительно-восстановительных ферментов, например в формат-дегидрогеназе, и участвуют в проведении электронов через мембрану. Такие белки могли быть востребованы еще во времена LUCA, чтобы снимать электроны с внеклеточных доноров (например, кристаллов сульфида цинка) и использовать их для восстановления веществ внутри клетки. Функция современных комплексов bc1 и b6f – разветвление электронов – могла возникнуть только с появлением достаточно сильных окислителей. Появление кислородного фотосинтеза сделало такой сильный окислитель (кислород) доступным для биосферы, но до того единственным сильным окислителем были хлорофиллсодержащие фотосистемы. Большинство комплексов b6f типа встречаются у фотосинтетиков (цианобактерий, Chlorobi и гелиобактерий) и участвуют в фотосинтезе. Хлорофилл и каротин в составе комплексов b6f участвуют в регуляции транспорта электронов между фотосистемами в зависимости от освещенности.
Так что, скорее всего, первые комплексы b6f появились у процианобактерий путем объединения цитохрома b, белка Риске (он присутствует и в других редокс-ферментах, в том числе древних) и других субъединиц. Дальше они распространялись путем горизонтального переноса, в том числе вместе с генами фотосинтеза: у гелиобактерий все субъединицы b6f комплекса входят в супероперон фотосинтетических генов. У нефотосинтезирующих клеток светозависимая регуляция комплекса b6f не требовалась, хлорофилл и каротин терялись, и слияние субъединицы PetD с 4-спиральным цитохромом b6 помогало стабилизировать структуру комплексов после потери этих кофакторов. Дальнейшая эволюция цитохромных комплексов шла под давлением кислорода: они были оптимизированы для уменьшения образования повреждающих активных форм кислорода и приспособлены к работе в дыхательной цепи аэробного дыхания.
| <<< Назад Происхождение комплекса I (НАДН-хинон-оксидоредуктаза) |
Вперед >>> Происхождение цитохром-с-оксидазы |
- Разнообразие и происхождение гемов, хлорофиллов и родственных коферментов
- Разнообразие и эволюция гем-содержащих белков
- Разнообразие и эволюция хинонов
- Разнообразие электрон-транспортных цепей
- Модульная структура окислительно-восстановительных ферментов
- Происхождение комплекса I (НАДН-хинон-оксидоредуктаза)
- Происхождение цитохромных комплексов bc1 (комплекс III) и b6f
- Происхождение цитохром-с-оксидазы
- Эволюция фотосистем
- Доступность окислителей и восстановителей на древней Земле
- Энергетика LUCA, первых бактерий и архей
- Глава 17 Происхождение компонентов биоэнергетических систем
- Происхождение Рюриковичей: ДНК-генеалогия доказывает
- Глава III. Планетарная роль почвы
- Происхождение растений
- Глава III Турбулентные выбросы в атмосфере
- Часть III Микробиология и другие науки
- Глава 7. Происхождение человека и половой отбор
- Раздел III. Население Мира
- 2. ПРОИСХОЖДЕНИЕ ВОДОРОСЛЕЙ
- 3. ПРОИСХОЖДЕНИЕ ГРИБОВ
- Глава III Очерки и рассказы о животных
- 4. ПРОИСХОЖДЕНИЕ ЖЕНСКОГО ГАМЕТОФИТА ЦВЕТКОВЫХ РАСТЕНИЙ
