Книга: Удивительный мир органической химии
8.1. Основа жизни
| <<< Назад Глава 8 Белки, жиры и углеводы |
Вперед >>> 8.2. Жир или масло? |
8.1. Основа жизни
Наиболее важными соединениями, которые входят в состав живых организмов, являются белки (протеиды). Белки служат основой всего живого на нашей планете.
Белки играют огромную биологическую роль, являясь тем основным веществом, из которого построены клетки животного организма (в растительных клетках белка содержится меньше). Однако и в жизни растений белки играют такую же важную роль, как и в жизни животных.
Белки участвуют в важнейших процессах живого организма — обмене веществ, размножении, росте организма, работе мышц, желез и т. д. Белки входят в состав многих ферментов, гормонов, нуклеопротеидов и др. Так, для каждой химической реакции, протекающей в живом организме, необходим строго «свой» фермент, а значит, и «свой» белок. Белки входят в состав пищевых продуктов. Мы уже говорили, что ежедневно для здорового человека необходимо не менее 100 г белка.
Первым исследователем белков был итальянский ученый Якопо Бартоломео Беккари (1682-1766). В 1728 г. он выделил из пшеничной муки клейкую массу, которую назвал клейковиной. Оказалось, что ее свойства напоминали поведение веществ, выделенных из животных организмов. Например, и клейковина, и эти вещества при перегонке выделяли «летучие щелочи» (смесь аммиака и аминов). Уже в 1745 г. ученый пришел к важному выводу: в природе существуют особые вещества, которые встречаются и в растениях, и в животном мире. Так было положено начало изучению этих загадочных веществ. В 1838 г. голландский ученый Жерар Мульдер писал: «Есть в растениях и животных вещество, которое, без сомнения, является самым важным из всех известных веществ в живой природе и без которого жизнь на нашей планете была бы невозможна. Это вещество называют белком». Однако по совету Й. Берцелиуса ученый назвал такое вещество протеином (от греч. протос — первый, главнейший).
Однако дальнейшее изучение белков столкнулось с огромными трудностями. С одной стороны, белки оказались настолько сложными веществами, что химики на первых порах не знали, как к ним подступиться. С другой же стороны, ученые того времени располагали очень низким уровнем экспериментальных методов исследования в органической химии. Что же они могли противопоставить «тайне» белка? Свою интуицию, умение мыслить и еще, что не менее важно, свои умелые руки экспериментатора. Но этого было недостаточно.
Однако уже тогда наметились основные методы работы с белками. Так, широкое распространение при изучении строения этих веществ получил метод гидролиза — расщепление белка под действием растворов кислот. В результате гидролиза белок распадался на менее сложные вещества — аминокислоты.
Итак, к концу XIX в. был накоплен экспериментальный материал, который позволял предположить, что белки состоят из более простых веществ — аминокислот. На съезде немецких естествоиспытателей в 1889 г. выступил немецкий химик Франц Гофмейстер с предложением рассматривать белковую молекулу как линейную, состоящую из остатков аминокислот.
С 1899 г. исследованием белков начал заниматься Э. Фишер — один из основоположников биоорганической химии. Он не только изучал свойства белков, но и пытался их синтезировать. В результате многолетних исследований Э. Фишер сделал важное обобщение: из аминокислот построены все белки — растительного, животного и микробного происхождения. Он также установил, что разные белки состоят из разных аминокислот и в разном количестве.
Однако огромное многообразие белков трудно было объяснить простым изменением количеств аминокислот, пусть даже и разных. По предположению Э. Фишера, такое многообразие может зависеть от различного взаимного расположения аминокислот в огромной молекуле белка. Это была гениальная догадка!
И все же перед ученым стоял другой, не менее важный вопрос: как связываются между собой аминокислоты в молекуле белка?
Еще в 1888 г. русский биохимик Александр Яковлевич Данилевский (1838-1923) высказал мысль о том, что аминокислоты в белках соединяются между собой при помощи амидной (пептидной) группировки —СО—NH—, которая образуется в результате взаимодействия между собой двух групп — карбоксильной и аминной. Эта мысль была подтверждена в 1902 г. Э. Фишером и Ф. Гофмейстером. Действительно, аминогруппа одной аминокислоты может взаимодействовать с карбоксильной группой другой аминокислоты. Например:
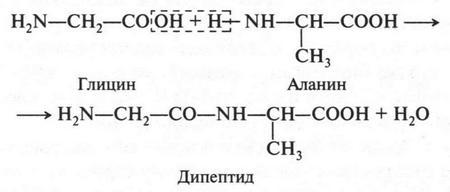
При присоединении к дипептиду третьей молекулы аминокислоты образуется трипептид и т. д.:
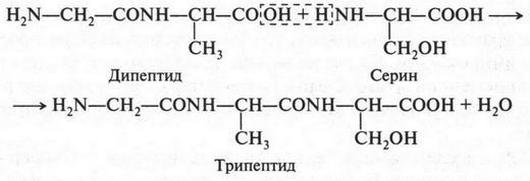
Такой процесс можно сравнить с постепенным нанизыванием бус на нить. При этом аминокислотные остатки соединяются друг с другом при помощи пептидных связей. Таким образом, белки представляют собой длинные нити последовательно соединенных друг с другом аминокислот — полипептиды. Так возникла полипептидная теория Э. Фишера. Чтобы доказать ее правильность, ученому потребовалось шесть лет упорного труда.
К началу 1902 г. уже было известно 17 аминокислот, входящих в состав белка. Э. Фишер начал серию опытов по получению некоторых полипептидов из этих аминокислот. В 1907 г. он синтезировал октадекапептид, содержащий 18 аминокислотных остатков! Еще дальше пошел его ученик — немецкий биохимик Э. Абдергальден (1877-1950), который в 1916 г. синтезировал полипептид, состоящий из 19 остатков аминокислот. По свойствам эти полипептиды напоминали природные белки. Они даже расщеплялись ферментами на аминокислоты. Подумать только: ферменты «признавали» эти полипептиды за природные белки!
Итак, было установлено, что белки представляют собой сложные органические соединения с высокой молекулярной массой, молекулы которых состоят из большого числа аминокислотных остатков. А ведь это большое число образовано лишь двадцатью различными аминокислотами. Просто удивительно — весь мир, живой и растительный, построен из этих двадцати различных аминокислот! Но удивительным это кажется только на первый взгляд. Действительно, с увеличением количества аминокислот, участвующих в образовании белковой молекулы, число различных белков быстро растет. Другими словами, растет число изомеров белка. Например, если молекула белка состоит из 20 разных остатков аминокислот, то число всевозможных комбинаций структур белка достигает гигантской величины — 2 • 1018. Вот откуда такое многообразие белков!
Однако белки нас удивляют еще и тем, что в их состав входят остатки только ?-аминокислот. Вот еще одна загадка природы.
Но не следует думать, что молекула белка — всего лишь длинная цепочка с чередующимися аминокислотными остатками. Конечно, очень важно знать порядок такого чередования в полипептидной цепи, определяющей первичную структуру молекулы белка (рис. 25). Стоит заменить только один аминокислотный остаток другим или даже поменять его место в цепи — сразу же резко меняются свойства белка. Например, если в молекуле гемоглобина, содержащей 574 аминокислотных остатка, вдруг произойдет случайная подмена глутаминовой кислоты на валин или даже изменятся места их взаимного расположения в полипептидной цепи, то это может печально закончиться — такой сбой вызовет тяжелое заболевание. Поэтому любой белок состоит из строгой последовательности аминокислотных остатков. Однако, к нашему счастью, живая природа сама по себе редко ошибается. Хотя вероятность такой ошибки огромна. Помните, сколько различных комбинаций (изомеров) образуется из 20 различных аминокислот? Но если их и не двадцать, а меньше, то и тогда таких перестановок будет вполне достаточно. Вот почему важно знать последовательность аминокислотных остатков в полипептидной цепи.
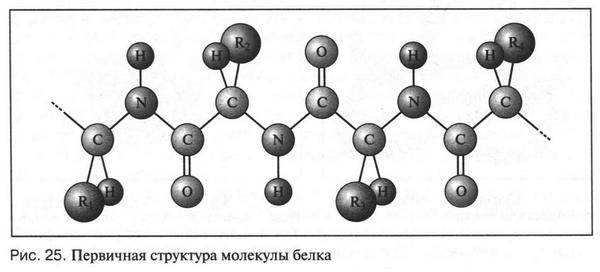
Однако сложность строения молекулы белка не ограничивается только первичной структурой. Оказывается, полипептидная цепь в зависимости от первичной структуры принимает определенное расположение в пространстве. Такое пространственное расположение также бывает различным. В связи с этим различают вторичную, третичную и четвертичную структуры.
Рассмотрим вначале вторичную структуру. Как уже говорили, огромная молекула белка — не только длинная нитеобразная цепь. У многих белков эта цепь скручена в цилиндрическую спираль. Выдающийся американский химик и физик Лайнус Полинг (1901-1994)

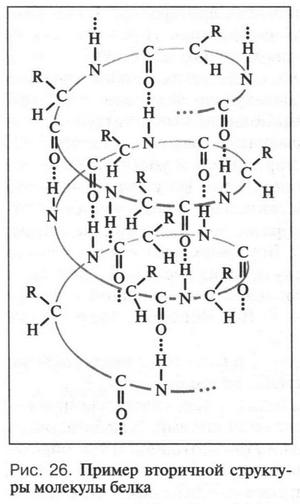
Однако закрученная в спираль полипептидная цепь может принимать в пространстве еще более сложную конфигурацию (структуру). Такая спираль способна скручиваться в клубок (рис. 27), как это происходит с новой спиралью от электрической плиты. Вызвано это тем, что водородные связи образуются не только между карбонильной группой и аминогруппой, но и между этими группами и молекулами воды. При этом некоторые из этих групп разворачиваются в ту сторону, где их «ждут» молекулы воды. В результате такой пространственной ориентации некоторые участки спирали вынуждены сближаться, спираль при этом изгибается и возникает клубок. Это — третичная структура. Белки, молекулы которых состоят из одной полипептидной цепи, имеют только первичную, вторичную и третичную структуры. Если же в состав молекулы белка входят две или более полипептидных цепей, то образуется четвертичная структура.
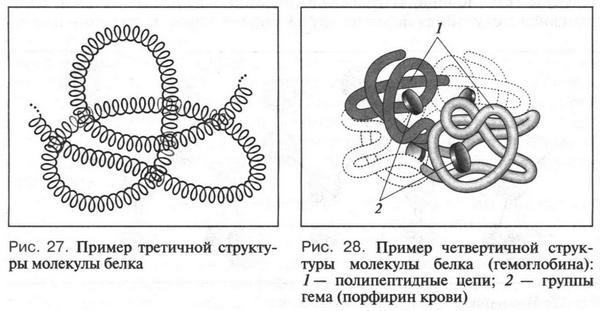
Четвертичная структура — это объединение нескольких полипептидных цепей в единый, очень сложный комплекс. Он определяет все свойства белка. Четвертичную структуру имеет, например, гемоглобин (рис. 28). В состав его молекулы входят четыре полипептидные цепи. С каждой цепью связана одна особая группа — гем, к которой присоединяется молекула кислорода.
В настоящее время ученые многих стран ведут интенсивные исследования белков, в том числе ферментов и гормонов. Все эти работы направлены к одной цели — химическому синтезу белка. Синтез белка — труднейшая задача, и для ее решения нужно ответить на многие сложные вопросы. Первый из них — установление строения белковых молекул, расшифровка их структуры. Если этот вопрос решить, то можно подойти и к решению второго вопроса: к синтезу более простых веществ, но построенных по тому же типу, что и белки. Такими веществами являются, например, полипептиды.
Как же химики и биологи устанавливают аминокислотный состав белков? Для этого они используют чаще всего метод гидролиза, который, как известно, состоит в том, что на белок действуют или ферментами, или кипятят его в растворе соляной кислоты несколько часов. При этом белок распадается на отдельные аминокислоты.
Но знать, из каких аминокислот построен белок, — это одно, а расшифровать, в какой последовательности эти аминокислоты соединены между собой в полипептидной цепи, — совсем другое!
С этой целью приходится проводить гидролиз постепенно, последовательно отщепляя одну молекулу аминокислоты за другой, определяя при этом и их строение. Можете представить, какая это сложная и кропотливая работа!
В 1954 г. была одержана первая большая победа — расшифрована структура белка инсулина, регулирующего сахарный обмен в организме. Чтобы установить формулу этого гормона, английскому биохимику Фредерику Сенгеру потребовалось 10 лет. Формула молекулы этого белка — C254H377O75N65S6. Оказалось, что эта молекула состоит из двух полипептидных цепей. В состав одной из них входит 21 аминокислотный остаток, а в состав второй — 30. Эти полипептидные цепи связаны друг с другом S—S-связями. За расшифровку строения белков, в том числе и инсулина, в 1958 г. Ф. Сенгер был удостоен Нобелевской премии. Почему же ученый выбрал инсулин, а не другой белок? Во-первых, потому, что, как ему показалось, изучив строение этого гормона, можно будет понять, почему он так активен, чем вызвана его способность автоматически регулировать содержание сахара в крови. Во-вторых, что не менее важно, этот белок удалось получить в чистом виде. Это очень важно для опытов. В-третьих, молекула инсулина не так уж и сложна. Среди других белков, сложнейших по структуре, молекула этого гормона — просто «карлик» (хотя этот «карлик» содержит 777 атомов!). Однако, несмотря на кажущуюся простоту этого белка, на расшифровку каждой полипептидной цепи Ф. Сенгер потратил по одному году. Еще восемь лет ушло на решение других вопросов, связанных с установлением места расположения мостиков, соединяющих обе цепи, как закручены и как уложены полипептидные цепи и т. д. Вот как трудно решалась проблема с установлением строения этого важного для человека гормона. Однако работа Ф. Сенгера имела и другое значение — она наметила основные пути синтеза этого гормона. В результате в 1960-1970 гг. синтез инсулина был осуществлен коллективами ученых США, ФРГ и СССР.
Работа ученых по расшифровке и синтезу белков продолжалась. Так, в 1966 г. был синтезирован гормон секретин, который стимулирует выделение поджелудочной железой воды и бикарбонатов. Этот полипептид содержит 27 аминокислотных остатков. Через два года был осуществлен синтез еще более сложного белка — рибонуклеазы, состоящей из 124 остатков аминокислот. Однако и это уже не предел. За последние десятилетия в изучении первичной структуры белков и их синтеза достигнут значительный прогресс. Ежегодно устанавливают полную структуру около 100 новых белков. При этом расшифровываются довольно сложные белки — ферменты. Например, в 1980 г. было расшифровано строение сложнейших ферментов — производных нуклеиновых кислот, полипептидные цепи которых состоят из 1342 и 1407 аминокислотных остатков! Через год был синтезирован полипептид, содержащий 41 остаток аминокислоты. Уже сегодня известны первичные структуры более 2 тыс. белков. Это стало возможным с появлением в биохимии новых методов исследования, современных приборов, широкого использования ЭВМ. Так, с привлечением компьютерной техники была получена информация о пространственной структуре некоторых белков, молекулы которых содержат многие тысячи атомов. А совсем недавняя победа ученых просто потрясает воображение: получена полная картина строения генома человека!
Для синтеза белковых молекул широко используют твердофазный синтез. Он состоит в том, что на полимерном носителе — матрице — закрепляется первая молекула аминокислоты, а потом к ней последовательно «подшиваются» все новые и новые молекулы других аминокислот. Затем готовая полипептидная цепь снимается с носителя. Поскольку все операции «прикрепления» молекул проводятся в строгой последовательности, то ученые смогли создать специальные приборы — автоматы, которые по заданной программе выполняют сложнейшую работу — соединяют с необходимой последовательностью друг с другом различные аминокислоты. Это не только облегчило, но и ускорило проведение таких синтезов. Представьте себе получение рибонуклеазы: для ее синтеза нужно было провести более 10 тыс. отдельных химических операций!
Задача завтрашнего дня — еще более грандиозна: синтез сложных белков, полипептидные цепи которых содержат многие сотни аминокислотных остатков. Можно только представить, какие перспективы откроются перед человечеством, когда ученые смогут управлять целенаправленным синтезом любых белков.
| <<< Назад Глава 8 Белки, жиры и углеводы |
Вперед >>> 8.2. Жир или масло? |
- Вода, спринцовка жизни
- Трансляция
- 1.2.6. Гравитация, инерция и приливные силы
- § 72 Как создать движущееся изображение
- 5.2. Абиотические факторы среды
- Проверьте свои знания
- На острове сокровищ
- Чиж (рис. VIII)
- Зонтик для кота
- Станет ли дно мирового океана новым Клондайком?
- 3.2. Воспроизведение организмов, его значение. Способы размножения, сходство и отличие полового и бесполого размножения....
- 100 великих географических открытий
