Книга: Удивительный мир органической химии
5.1. Спирты, они же — алкоголи
| <<< Назад Глава 5 О веществах с гидроксильной группой |
Вперед >>> 5.2. Та же группа, но уже кислая |
5.1. Спирты, они же — алкоголи
Давайте поговорим о веществах, в молекулах которых содержится группа, состоящая из атомов кислорода и водорода. Такая группа называется гидроксильной. Химики хорошо знают эту группу — она входит в состав очень распространенного на Земле вещества — воды. Но, оказывается, не только вода является обладателем гидроксила. Существует множество и других веществ, в молекулах которых имеется эта группа. Например, ее содержат спирты, фенолы, нафтолы, карбоновые кислоты и другие соединения. Своим присутствием она объединяет эти несхожие вещества, но в то же время и отличает от тех, которые не содержат эту группу. Например, метан в воде не растворяется, а его гидроксильное производное — метиловый спирт СН3ОН в воде растворяется очень хорошо. Т. кип. газа метана —161,5 °С, а т. кип. метилового спирта — +64,7 °С. Разница существенная — более 226 °С! Оказывается, во всем «виновна» гидроксильная группа.
В чем же ее «вина»?
Было установлено, что молекулы веществ, содержащие эту группу, как бы «слипаются» друг с другом. Чтобы отделить их, требуется значительная энергия. А вот молекулы метана, не содержащие «липких» групп, легко разлетаются в разные стороны. Почему же гидроксильные группы придают молекулам спирта такую необычную «липкость»? Дело в том, что в гидроксильной группе электронная плотность смещена в сторону кислородного атома (атом кислорода — более электроотрицательный элемент, и он оттягивает электроны в свою сторону). В результате на атомах кислорода и водорода появляются частичные заряды ?- и ?+.
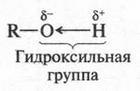
Благодаря этим зарядам (они, как видите, противоположны друг другу) гидроксильные группы притягиваются одна к другой:
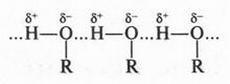
Возникшую связь между молекулами спирта называют водородной связью и обозначают тремя точками. Эта связь очень слабая, в 20 раз слабее обычной ковалентной связи, но она играет огромную роль. Так, благодаря этой связи существуют такие вещества, как белки, нуклеиновые кислоты и другие, которые входят в состав нашего организма.
Самыми известными органическими соединениями с гидроксильной группой являются спирты (алкоголи). В молекулах этих веществ гидроксильная группа связана с углеводородным радикалом.
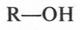
Поскольку радикалы могут быть различными, то и спирты бывают разными. Мы же начнем разговор с самого известного спирта — этилового (этанола).
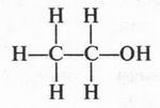
Эту формулу можно писать более сокращенно: Н3С—СН2ОН или совсем кратко — С2Н5ОН. Теперь ясно, почему этот спирт называют этиловым: гидроксильная группа связана с этильным радикалом (С2Н5—).
История этилового спирта теряется в глубине веков. Более чем за четыре тысячи лет до нашей эры древние народы Средиземноморья умели делать опьяняющий напиток — вино, сбраживая виноградный сок. Такой процесс сейчас называют брожением. Он состоит в том, что в фруктовые соки, стоящие продолжительное время на воздухе, попадают микроорганизмы, которые способны питаться содержащимся в соке сахаром. При этом они превращают сахар в спирт, а выделяющуюся энергию используют для своего размножения и роста. Перебродивший виноградный сок называется вином.
Однако прошло достаточно много времени, прежде чем химики научились выделять из вина винный спирт (т. е. чистый этиловый спирт). Впервые это проделали в Италии в XI в. Вино нагревали в реторте до кипения, а потом охлаждали образующиеся пары, пропуская их через согнутую в спираль медную трубку. Эта трубка играла роль холодильника, и ее часто опускали в бочку с водой.
В средние века люди считали этиловый спирт одним из сильнейших лекарственных средств и поэтому называли его «жизненной водой» (aqua vitae). Знаменитый немецкий врач и естествоиспытатель Теофраст Парацельс (1493-1541) — первый, по словам А. И. Герцена, «профессор химии от сотворения мира», назвал этиловый спирт алкоголем (от араб. alkohol{Хотя слово «алкоголь» взято из арабского языка, сами арабы называют этиловый алкоголь английским словом «спирт».} — тонкий порошок). В XIX в. это название по предложению Й. Берцелиуса было распространено на весь класс спиртов.
Долгое время химики не могли установить эмпирическую формулу этилового спирта, хотя еще в 1780 г. А. Лавуазье определил, что «жизненная вода» состоит из углерода, водорода и кислорода. Наконец, в 1833 г. эта формула была установлена, и заслуга в этом принадлежит Й. Берцелиусу.
Этиловый спирт — бесцветная жидкость со слабым, но характерным спиртовым запахом, кипящая при температуре 78,3 °С. Обычно в химических лабораториях используют 96%-й спирт (4% воды очень трудно извлечь из спирта). Такой спирт называется ректификатом. Если же спирт продолжительное время кипятить на водяной бане со свежепрокаленным оксидом кальция (при этом используют специальный холодильник, чтобы спирт не испарился. Кстати, такой холодильник изобрел Ю. Либих), то получают «абсолютный» этиловый спирт. Он содержит всего 0,5% воды. Этот спирт жадно поглощает влагу даже из воздуха и превращается в обычный ректификат.
Этиловый спирт можно получать различными способами. Об одном из них — брожении виноградного сока — мы уже говорили. Добавим, что подвергаться брожению могут и другие пищевые продукты, содержащие сахаристые вещества (например, крахмал). С этой целью чаще всего используют зерно, реже — овощи (картофель, сахарную свеклу), фрукты. При этом добавляют специальные ферменты, например дрожжи. Химический процесс, который называется спиртовым брожением, кратко можно записать так:
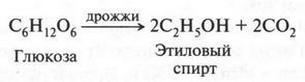
Полученный этим способом этиловый спирт называют пищевым или винным спиртом.
Для получения этилового спирта можно использовать даже древесину. Содержащуюся в ней целлюлозу подвергают гидролизу и получают глюкозу, а из глюкозы — спирт. Такой спирт называется гидролизным. Этот способ очень выгодный. Действительно, из 1 т древесины можно получить до 200 л этилового спирта. Этим можно сэкономить 1,5 т картофеля или 0,7 т зерна.
Для получения этилового спирта используют и синтетические способы. Как известно, этилен в присутствии катализатора (концентрированная серная или фосфорная кислота) присоединяет воду и превращается в этиловый спирт:
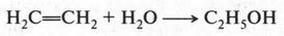
Этиловый спирт используют во многих отраслях промышленности, но особенно в химической. Он незаменим при производстве синтетического каучука, уксусной кислоты, пороха, пластмасс. Кроме того, этиловый спирт — прекрасный растворитель для многих веществ, особенно органических. Без этилового спирта не обходится медицина. Его антисептические свойства хорошо известны всем. Однако необходимо сказать и о том, что этиловый спирт используют для приготовления алкогольных напитков. Вот тут мы должны сделать небольшое, но важное отступление. Известно, что этиловый спирт — сильный наркотик. Попадая в организм, он быстро всасывается в кровь и приводит его в возбужденное состояние, при котором человеку трудно контролировать свои поступки. Так, потребление алкогольных напитков часто является причиной тяжелых дорожно-транспортных аварий, несчастных случаев на производстве и бытовых преступлений. Об этом мы читаем в газетах, видим по телевидению, слышим по радио. Нередко наблюдаем это в повседневной жизни. Сколько трагедий, несчастий, слез из-за нескольких рюмок выпитой водки! Нужно отметить, что спирт опасен в любой концентрации (вино, настойка, пиво). Особенно вреден алкоголь для молодежи, не говоря уже о детях и подростках. Алкоголь обладает коварным свойством: с маленьких доз начинается привыкание организма к алкоголю. Это, как известно, заканчивается тяжелой и трудноизлечимой болезнью — алкоголизмом.
Но этиловый спирт — не только наркотик, но и яд. Спирт действует на организм в целом. Он вызывает тяжелые заболевания нервной и сердечно-сосудистой системы. Страдает также желудочно-кишечный тракт. Особенно разрушает он печень — естественную «биофабрику», очищающую, в частности, организм от алкоголя. Установлено, что скорость такого очищения довольно мала: за один час печень может переработать не более 10 мл спирта, окисляя его в конечном счете до СO2 и воды. Этот процесс идет через образование промежуточных продуктов — уксусного альдегида и уксусной кислоты. Разумеется, что значительное количество спирта еще долго «гуляет» по организму, разрушая печень, желудок, кишечник, сердце и особенно — мозг. Вот что писал по этому поводу профессор И. А. Сытинский — видный специалист-биохимик, исследовавший действие алкоголя на организм: «Алкоголь — специфический нервный яд. Хорошо растворяясь в жирах, которыми особенно богата ткань головного мозга, он накапливается в мозге в больших количествах, чем в других органах».
Какими же химическими свойствами обладают спирты? Сразу же отметим, что эти свойства определяются в первую очередь гидроксильной группой. Как мы уже знаем, эта группа частично поляризована, т. е. электронная плотность смещена в сторону кислородного атома. Поэтому связь водородного атома с атомом кислорода несколько ослаблена. Этот водородный атом намного «кислее», чем в молекуле ацетилена. Но это не означает, что водородный атом может оторваться от молекулы спирта. Иначе бы спирт обладал кислотными свойствами. Но спирты — не кислоты, а нейтральные вещества. Даже обычная вода «кислее» спиртов! Но все же водородный атом в гидроксильной группе можно заместить на металл, но не на любой, а на очень активный, например на натрий:

Такой продукт замещения называется алкоголятом натрия. Конечно, теоретически можно рассматривать этот продукт как «соль» спирта. Но только теоретически. Ведь спирты, еще раз повторяем, нейтральные вещества, а не кислоты. Более того, спирты даже способны взаимодействовать с кислотами — органическими и неорганическими:
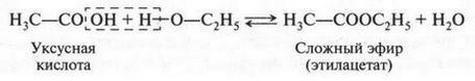
Реакция взаимодействия спиртов с кислотами, в результате которой образуются сложные эфиры, называется реакцией этерификации. Такие реакции идут «туда-сюда»: при взаимодействии кислоты со спиртом образуется сложный эфир, а при действии на него водой получаются снова исходные вещества — кислота и спирт. Поэтому такие реакции называют обратимыми. Сложные эфиры находят применение в органическом синтезе. Кроме того, эти эфиры, образованные из спиртов и органических кислот, часто служат в качестве эссенций, способных имитировать запахи натуральных фруктов и растений. Поэтому некоторые из эфиров добавляют в мыла, шампуни, зубные пасты в качестве отдушек.
Если же спирт нагреть с концентрированной серной кислотой, то получается другое вещество — простой эфир. Разные спирты образуют разные простые эфиры. Например, из этилового спирта образуется диэтиловый эфир:
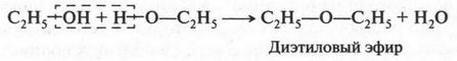
Диэтиловый эфир (его часто называют просто этиловым эфиром) — низкокипящая жидкость (34,5 °С). Он полностью испаряется, если его немного налить в ладонь руки. При работе с эфиром нужно помнить о его очень высокой огнеопасности. Работая даже вдали от источника огня, нельзя поручиться, что эфир не вспыхнет. Это может произойти потому, что пары эфира в 2,5 раза тяжелее воздуха и они способны «стелиться» по поверхности лабораторного стола на значительное расстояние.
История открытия диэтилового эфира противоречива. Некоторые историки химии утверждают, что эфир был открыт еще в 1200 г. испанским алхимиком Раймундом Луллием (1235-1315). В то же время в «Истории химии» Микеле Джуа говорится, что эфир стал известен около 1560 г. под названием «истинного услащенного купоросного масла». Однако хорошо известно, что с эфиром был знаком Т. Парацельс. Более того, есть сведения, что этот знаменитый ученый открыл в 1525 г. (или в 1540 г.) обезболивающее и наркотическое действие этого эфира.
Диэтиловый эфир часто применяют в качестве растворителя, а также в производстве бездымного пороха, искусственного шелка. Но особую известность он получил среди хирургов. Его впервые применили в медицине в качестве обезболивающего средства. Но об этом мы поговорим позже.
Однако вернемся к спиртам. Кроме этилового спирта, существуют и другие. Например, у этилового спирта есть его «младший брат» — метиловый спирт Н3С—ОН. Назван он так потому, что гидроксильная группа связана с метальным радикалом (СН3—). Чаще этот спирт называют метанолом. Впервые его синтезировал П. Бертло в 1858 г. из углерода и серы. Этот синтез (из элементов!) можно представить в виде такой схемы:
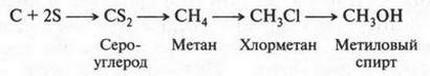
Спустя много времени метиловый спирт стали получать нагреванием древесины без доступа воздуха. Образующиеся при этом пары сжижали, получая много различных веществ. Среди них был и метиловый спирт, который назвали древесным. Кстати, название «метиловый спирт» происходит от греческих слов, обозначающих «древесное вино». Поскольку этот спирт в молекуле содержит один атом углерода, то и соответствующий углеводород с одним углеродным атомом также решили назвать метаном. Так произошло название самого первого члена гомологического ряда алканов. В настоящее время метиловый спирт получают из синтез-газа (СО + Н2) при его нагревании в присутствии катализаторов:
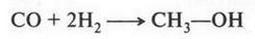
Метиловый спирт применяют в органической химии для получения огромного количества разнообразных органических соединений. Его можно использовать даже в качестве добавки в бензин. В результате повышается октановое число бензина.
Но теперь о главном. Метиловый спирт — сильнейший яд. Несколько граммов этого спирта, попавшего в организм человека, приводят вначале к полной потере зрения, а немного большее количество — к смерти. Поэтому метиловый спирт для технических целей обязательно сопровождается надписью «Метанол — яд» и хранится в специальном помещении или сейфе.
Если в молекуле спирта содержатся три углеродных атома, то такой спирт называют пропиловым (опять же — по названию радикала). Но официальное его название — пропанол-1:
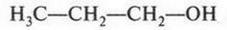
Этому спирту соответствует другой спирт с тем же числом углеродных и водородных атомов, но иного строения — изопропиловый спирт (пропанол-2).
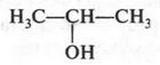
Как известно, эти спирты — изомеры. В молекуле пропилового спирта гидроксильная группа связана с группой —СH2, а в молекуле изопропилового спирта — с группой
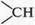
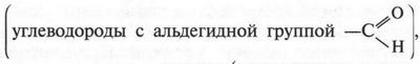
а при окислении вторичных спиртов — кетоны (углеводороды с группой
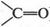
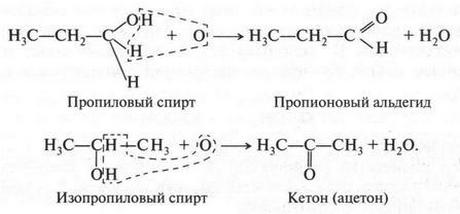
В этих реакциях атом кислорода «забирает» водород от спиртов. В результате образуются «безводородные алкоголи». В связи с этим возник термин «альдегид» (от лат. слов alcohol dehydrogenatus). Из первых частей этих слов Ю. Либих в 1835 г. составил слово «альдегид».
Кроме метилового, этилового и пропилового спиртов, существует множество других — бутиловый, пентиловый, гексиловый и т. д. Кроме того, у каждого из них имеются еще и изомеры. Чем больше углеродных атомов в молекуле спирта, тем больше изомеров. При этом число изомеров у спиртов растет быстрее, чем у алканов.
Спирты, содержащие в молекуле свыше 10 углеродных атомов, называются высшими спиртами. Когда-то их выделяли из природных жиров. Так, из кокосового масла получали лауриловый спирт С12Н25ОН, из спермацета — цетиловый спирт С16Н33ОН, из пчелинового воска — цериловый С26Н53ОН и мирициловый С30Н61ОН спирты. Но природного сырья для получения высших спиртов было достаточно до тех пор, пока они применялись в ограниченном количестве. Однако начиная с 40-х гг. XX в. эти спирты стали использовать в производстве поверхностно-активных веществ (ПАВ) — алкилсульфатов, которые являются главной составной частью синтетических моющих средств (СМС). Потребовались большие количества высших спиртов. Выручил, как всегда, органический синтез. Высшие спирты стали получать окислением алканов в присутствии катализатора (солей марганца). Этот способ разработал и внедрил в производство в 1946 г. известный химик-технолог Андрей Николаевич Башкиров (1903-1982). По химическим свойствам высшие спирты практически не отличаются от обычных спиртов. Правда, они легче окисляются и медленнее реагируют с активными металлами.
До сих пор речь шла о спиртах, в молекулах которых содержится одна гидроксильная группа. Но есть спирты, в которых таких групп несколько. Количество гидроксильных групп определяет атомность спиртов. Так, спирты с одной гидроксильной группой (метиловый, этиловый, пропиловый и т. д.) называются одноатомными спиртами, с двумя гидроксильными группами — двухатомными, с тремя — трехатомными и т. д. Основным двухатомным спиртом является этиленгликоль:
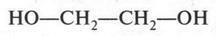
Этот спирт впервые открыл А. Вюрц в 1856 г. Этиленгликоль — вязкая бесцветная жидкость, сладкая на вкус. Она обладает ядовитыми свойствами. Применяют этот спирт в химической промышленности для синтеза многих органических продуктов. Многие знают, что водные растворы этиленгликоля используют в качестве антифризов (незамерзающих при низкой температуре жидкостей) для охлаждения двигателей внутреннего сгорания в зимний период. Например, водный раствор, содержащий 60% этиленгликоля, замерзает только при —49 °С.
Гликоли — типичные спирты. Но присутствие двух гидроксильных групп несколько отличает их от одноатомных спиртов. Так, они немного «кислее», чем одноатомные спирты. Поэтому свои водородные атомы в гидроксильных группах они могут заменять не только на активные металлы, но и на другие, например медь.
Если в молекуле спирта содержатся три гидроксильные группы, то это — глицерины. Однако из всех трехатомных спиртов самым известным является «настоящий» глицерин.
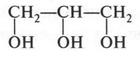
Глицерин был открыт К. Шееле в 1779 г., но его строение установлено гораздо позже. Это сделал П. Бертло в 1854 г. Пожалуй, нет такого человека, который бы не был знаком с глицерином. Глицерин — вязкая жидкость, еще более сладкая (от греч. гликос — сладкий), чем этиленгликоль. Получают глицерин омылением жиров или синтетически из газа — пропилена. Применяют этот спирт в быту, обрабатывая им некоторые материалы (кожу, некоторые ткани), которые после этого приобретают мягкость и эластичность. Используют глицерин в медицине и парфюмерии. Но особое значение он имеет в химической промышленности. Без глицерина не обходится получение взрывчатых веществ, антифризов, полимеров и других веществ. Если этиленгликоль ядовит, то глицерин безвреден. Его можно добавлять в кондитерские изделия, чтобы сохранить их сладость, сделать их нежнее и уберечь от высыхания. Глицерин не испаряется сам и не дает испаряться воде, прочно удерживая ее. Поэтому он используется в пищевой, ликероводочной, текстильной, кожевенной промышленности, в медицине. Глицерин содержится в организме человека. Соединяясь с молекулами высших кислот, он образует жиры, свойственные только для данного организма.
Но не только в воде и в спиртах присутствует гидроксильная группа. Недаром ее называют вездесущей группой. Присутствует она и в других веществах, мало напоминающих спирты. О таких веществах мы и расскажем в следующем разделе.
| <<< Назад Глава 5 О веществах с гидроксильной группой |
Вперед >>> 5.2. Та же группа, но уже кислая |
- О самоубийствах, алкоголизме и молодежи
- Когда лучше жениться? И когда бесу толкать в ребро?
- Миф № 50 Если бы у обезьян родился мутант (прямоходящая обезьяна), они бы сразу убили его… Значит, эволюция невозможна!
- Что можно узнать при изучении поврежденного мозга?
- Заключение
- Лекарство из яда
- Гуморальные факторы и сон
- Алкоголь
- Хлеб и дрожжи
- Что делать со стариками?
- Где надо жить, чтобы жить долго?
- Про правильную и неправильную еду
