Книга: Удивительный мир органической химии
5.2. Та же группа, но уже кислая
| <<< Назад 5.1. Спирты, они же — алкоголи |
Вперед >>> Глава 6 Два противоположных мира |
5.2. Та же группа, но уже кислая
Итак, если гидроксильная группа связана с водородом, то это — вода. Если же она связана с обычным углеводородным радикалом, это — спирт. Но есть и такие соединения, в которых гидроксильная группа соединена с бензольным кольцом. В этом случае будет совсем другое вещество, которое называется фенолом.
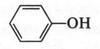
Впервые это вещество было выделено из каменноугольной смолы в 1834 г. Ф. Рунге. Сейчас фенол получают синтетическим путем из изопропилбензола (кумола). При его окислении образуется гидропероксид, который в присутствии серной кислоты и при нагревании разлагается на фенол и ацетон:
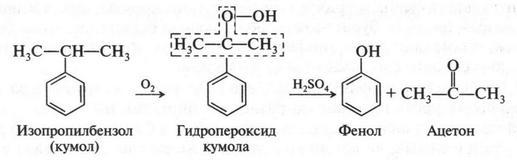
Этот способ был открыт в 1949 г. группой советских химиков под руководством Петра Гавриловича Сергеева (1885-1957).
Свое первое название фенол получил от старинного наименования бензола — фен. Однако О. Лоран, установивший состав фенола в 1842 г., назвал его фениловой кислотой или фенилгидратом. Но все же за этим соединением закрепилось название «фенол», так как оно обладает свойствами кислоты и спирта. Так, в водном растворе фенол обнаруживает кислую реакцию. Поэтому он получил еще одно название — карболовая кислота. Правда, это название сейчас используется довольно редко.
Фенол — кристаллическое вещество с т. пл. 43 °С, плохо растворимо в воде. Обычно бесцветное, окисляясь на воздухе, это вещество приобретает вначале розовую, а потом — бурую окраску. С фенолом нужно быть осторожным: при попадании на кожу он вызывает ожоги.
Фенол (точнее, его водный раствор) — первое и очень сильное антисептическое средство, введенное в 1867 г. шотландским хирургом Джозефом Листером в хирургическую практику. Кстати, этот хирург считается основоположником антисептической хирургии. В том же году фенол при хирургических операциях стал применять выдающийся русский хирург Николай Иванович Пирогов. Запах карболовой кислоты (карболки) был типичным запахом больниц и госпиталей.
Хорошо известны и производные фенола. Особенно распространено соединение, которое является «родственником» фенола. Это — крезол. Собственно, крезол — это смесь трех метильных производных фенола.
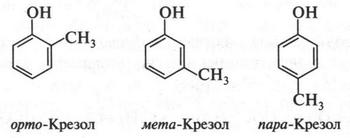
Крезолы получают перегонкой каменного угля без доступа воздуха (коксование угля). Обычно крезолы не разделяют, а используют их смесь, известную под названием трикрезола или просто крезола. Эту маслянистую жидкость темно-бурого цвета, обладающую бактерицидными свойствами, применяют для дезинфекции. Бактерицидные свойства фенола и крезола связаны с их кислотным характером.
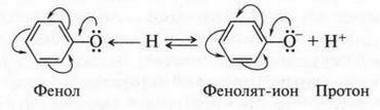
Можно только удивляться тому, что гидроксильная группа в разных соединениях проявляет себя по-разному. Спирт, как мы знаем, — соединение нейтральное, а фенол, содержащий ту же гидроксильную группу, — хотя и слабая, но все же кислота. Что же заставляет эту группу так менять свое поведение?
Чтобы ответить на этот вопрос, нужно всегда обращать внимание на то, с чем связана гидроксильная группа. Вот, оказывается, в чем дело! Если сравнить спирты и фенол, то видна разница: в спиртах гидроксил связан с алифатическими радикалами, а в фенолах — с бензольным кольцом. Если с гидроксильной группой связан обычный радикал, то он «отталкивает» от себя электронную плотность в сторону гидроксила, уменьшая тем самым его поляризацию, а значит, и способность водородного атома «отрываться» от молекулы. Что же касается бензольного кольца, то оно, наоборот, несколько оттягивает электронную плотность в свою сторону, увеличивая поляризацию гидроксильной группы. Это и способствует отрыву от нее атома водорода в виде протона:
Фенол, обладая слабокислотными свойствами, вступает со щелочами в обычные реакции нейтрализации:
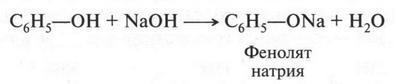
Образующаяся соль фенола называется фенолятом (звучит так же, как алкоголят!). Эта соль неустойчива и легко разлагается даже оксидом углерода (IV):
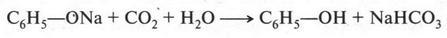
Итак, фенол — слабая кислота. Но, оказывается, кислотные свойства фенола можно резко усилить. Для этого в молекулу фенола нужно ввести три нитрогруппы. И вот вам — довольно сильная кислота — пикриновая (от греч. пикрос — горький).
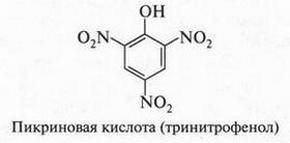
Эта кислота по силе превосходит уксусную кислоту.
Пикриновая кислота была получена в 1771 г. немецким химиком Питером Вульфом (1727(?)-1803) при действии на синий краситель (индиго) азотной кислотой. Образовавшаяся жидкость желтого цвета окрашивала шелк и шерсть в желтый цвет. Поэтому пикриновую кислоту стали использовать в качестве красителя. Однако ее строение долго оставалось неизвестным. Только в 1841 г. О. Лоран установил ее химическое строение.
Все шло, как обычно: химики получали эту кислоту, а текстильщики окрашивали ткани. И вдруг, спустя ровно 100 лет со дня открытия этой кислоты, оказалось, что она... взрывается! Обнаружили это в 1871 г., а в 1887 г. как бы в подтверждение этого произошел сильный взрыв на одной из красильных фабрик около г. Манчестера. Конечно, не обошлось, к сожалению, без жертв. Только после этого с пикриновой кислотой стали обращаться с осторожностью. Но ведь знали же, что кислота способна взрываться, и знали это на протяжении 16 лет до трагедии. Более того, за год до взрыва француз Тюрпен на основе пикриновой кислоты создал взрывчатое вещество — мелинит, которое было принято на вооружение во Франции...
Но продолжим разговор о феноле. Фенол — очень ценный продукт. Его используют для производства полимеров, красителей, лекарственных препаратов, взрывчатых веществ и др. Безвозвратно прошли те времена, когда фенолом обезвреживали выгребные ямы, свалки и даже туалеты. Сейчас фенол — настоящий клад для химиков. На основе этого вещества получают фенолформальдегидные полимеры, которые хорошо знакомы строителям, инженерам-конструкторам, специалистам многих профессий. Все началось с того, что А. Байер в 1872 г., нагревая фенол с формальдегидом, получил в колбе незнакомый смолообразный продукт. Такие продукты, от которых трудно отмыть лабораторную посуду, получали многие химики, вводя в реакцию некоторые вещества. Как обычно, такую посуду вместе со «смолой» выбрасывали на свалку. Точно так же поступил и А. Байер, не придав значения той «грязи», из-за которой пришлось проститься с колбой. Однако иначе поступил американский химик Лео Хендрик Бакеланд (1863-1944). Он не выбросил колбу со смолообразным веществом, а стал тщательно исследовать его. Он изменял условия проведения реакций, добавлял к полученной «смоле» различные вещества типа древесной муки или асбеста. В результате многочисленных экспериментов ученый получил полимер, пригодный к техническому использованию. Начиная с 1908 г. этот продукт стал широко применяться под названием бакелит. Можно так изобразить часть огромной молекулы этого полимера:
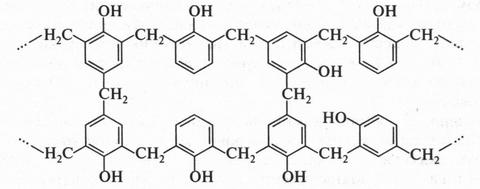
В настоящее время фенолформальдегидные полимеры используют для производства клеев, лаков, эмалей, твердых древесноволокнистых и древесностружечных плит (ДВП и ДСП), стеклотекстолита, а также для изготовления крупногабаритных панелей и плит для стен и перекрытий зданий, сборных конструкций складов, гаражей и т. д. В фенолформальдегидный полимер можно добавлять различные наполнители. С одной стороны, они снижают себестоимость полимера, а с другой — придают пластмассе новые качества. В зависимости от характера наполнителя полимерные материалы называются по-разному: фаолит (на основе асбеста), стекловолокнит (на основе стекловолокна), арзамит (на основе графита), гетинакс (на основе бумаги), текстолит (на основе тканей).
Всем знакомо слово «капрон». Но не все знают, что этот полимер (а именно он носит это название) вырабатывают из фенола. Правда, путь, который проделывает фенол, чтобы стать капроном, очень длительный и сложный. В конечном продукте (капроне) вы уже не увидите привычного бензольного кольца. Действительно, посмотрите на формулу капрона:
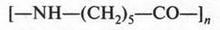
Капрон используют главным образом в качестве текстильных волокон, часто в комбинации с природными волокнами. Из них вырабатывают нити для вязания, канаты, парашютный шелк, небольшие детали (например, шестеренки) и т. д. Но особое значение это волокно приобрело для изготовления женских чулок, производство которых начато еще в 1939 г. (США).
Если в бензольное кольцо ввести две или три гидроксильные группы, то можно получить ряд двухатомных и трехатомных фенолов.
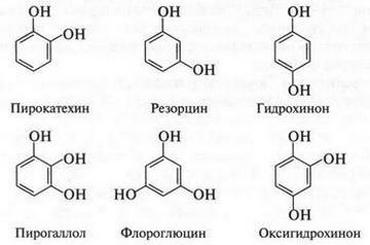
Многоатомные фенолы в химических реакциях могут участвовать одной, двумя и даже тремя гидроксильными группами. Такие фенолы — более сильные кислоты, чем обычный фенол. Они легче растворяются в воде, окисляются. Некоторые из производных этих фенолов применяют как лекарственные препараты, компоненты красителей, составные части фотопроявителей. Так, гидрохинон, полученный еще в 1830 г. при сухой перегонке хинной кислоты, нашел применение в фотографии в качестве восстановителя. Это связано с тем, что при окислении гидрохинон легко переходит в хинон (эта реакция обратима).
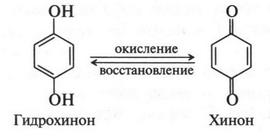
Эта реакция и легла в основу фотографического процесса. Гидрохинон при проявлении восстанавливает бромистое серебро до металлического, образуя черное изображение на бумаге.
Некоторые производные пирокатехина играют важную роль в жизнедеятельности человека и животных, например адреналин.
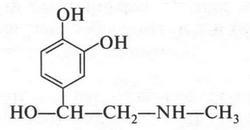
Адреналин — гормон. Его выделили из надпочечников и в 1902 г. установили его строение. Он способствует передаче нервного возбуждения, участвует в обмене веществ, а также влияет на деятельность сердечно-сосудистой системы.
Вот такая удивительная гидроксильная группа. И пусть не удивляет вас то, что в разных соединениях ее свойства проявляются по-разному.
| <<< Назад 5.1. Спирты, они же — алкоголи |
Вперед >>> Глава 6 Два противоположных мира |
- Морская торговля в Южной Америке и в Карибском море
- Миф № 50 Если бы у обезьян родился мутант (прямоходящая обезьяна), они бы сразу убили его… Значит, эволюция невозможна!
- Атомное «лего»
- 16.3.2. Технология вставки гена
- 4. Взаимоотношения между клетками
- XVII. Сады в дикой глуши
- Электрогенераторы у рыб
- Для чего служат ракеты
- Сложный, «растущий» LECA и темные века эволюции эукариот
- Что мы знаем о мегамире?
- Рептилии защищаются
- Чихачёв Платон Александрович
