Книга: Удивительный мир органической химии
4.3. «Ароматический» не означает «ароматный»
| <<< Назад 4.2. Как стать устойчивой? |
Вперед >>> 4.4. Бензольные кольца вместе и врозь |
4.3. «Ароматический» не означает «ароматный»
Мы расскажем о загадочном веществе, которое занимало умы многих химиков XIX в. на протяжении нескольких десятков лет. Речь пойдет о бензоле — веществе, которое сейчас хорошо знакомо каждому химику.
Бензол — легкая бесцветная жидкость со специфическим запахом. Очень плохо растворяется в воде. На воздухе горит сильно коптящим пламенем:

Бензол — очень ценный продукт. Он служит для получения огромного множества различных органических веществ.
У бензола интересная история. В начале XIX в. в столицах некоторых государств, в том числе и в Петербурге, улицы и площади уже пытались освещать с помощью газовых фонарей. Для этого использовали светильный (коксовый) газ, который получали при коксовании угля. Газ хранили в железных баллонах под давлением, которые держали в подвалах домов. Однако вскоре была замечена досадная закономерность: в летние ночи фонари горели ярко, а зимой, особенно в сильные морозы, они еле-еле светили. Это повторялось из года в год. И вот в Англии владельцы лондонского газового завода обратились за помощью к своему знаменитому земляку — физику и химику Майклу Фарадею (1791-1867) за консультацией. Ученый провел опыты со светильным газом и установил, что при охлаждении и давлении часть газа конденсируется и собирается на дне баллона в виде прозрачной жидкости. Эта жидкость легко замерзала при +5 °С и кипела при 80 °С. Анализ показал, что вещество состоит только из углерода и водорода. М. Фарадей назвал этот углеводород «карбюрированным водородом». Произошло это в 1820 г., а спустя семь лет немецкий химик Эйльгард Мичерлих (1794-1863), перегоняя бензойную кислоту с негашеной известью, выделил точно такую же жидкость. Он определил ее эмпирическую формулу, которая содержала шесть атомов углерода и столько же атомов водорода (С6Н6). Это соединение Э. Мичерлих назвал бензином, но Ю. Либих вскоре переименовал его в бензол (от нем. ?l — масло). Под таким названием это вещество теперь известно всем.
Спустя некоторое время бензол был обнаружен в каменноугольной смоле. Вскоре оказалось, что у бензола вообще много «родственников». Так, в течение каких-то двадцати лет были открыты анилин, фенол, хинон и другие вещества, в молекулах которых содержалась группировка из шести углеродных атомов. Со временем число таких соединений все увеличивалось. Они были обнаружены даже в пахучих смолах (например, ладане) и некоторых бальзамах, обладающих приятным запахом. Это и послужило причиной для А. Кекуле,

Итак, эмпирическая формула бензола была установлена — С6Н6. Она показывала, что бензол должен быть соединением непредельным, так как не отвечал общей формуле алканов (СnН2n+2). Если это так, то структурную формулу бензола можно представить в виде цепи с непредельными связями. Но оказалось, что таких формул может быть несколько:
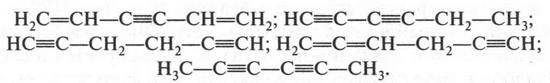
Однако вскоре все они были отвергнуты. Если вы помните, у химиков есть очень простая реакция, с помощью которой можно установить присутствие двойных или тройных связей в молекуле. Это — реакция с бромной водой. Вы уже знаете, что в этом случае непредельное соединение обесцвечивает красновато-бурый раствор бромной воды. Известна и другая качественная реакция — проба с раствором перманганата калия. И в этом случае происходит изменение цвета: слабо-розовый раствор становится бесцветным. Когда же попробовали добавить к бензолу тот или другой раствор, то никакого изменения цвета не произошло! Это означало только одно: молекула бензола не содержит ни двойных, ни тройных связей. Более того, на основании многих опытов было установлено, что все шесть водородных атомов в молекуле бензола равноценны. Из приведенных же выше структурных формул видно, что водородные атомы в них должны отличаться друг от друга: одни из них находятся при углероде с двойной связью, другие — с тройной. Это означает, что в химических реакциях они должны вести себя по-разному.
Разобраться в этих противоречиях было нелегко. Однако А. Кекуле думал о загадке бензола и днем, и ночью. И однажды...
Вот что писал А. Кекуле в 1865 г.: «Я сидел и писал учебник, но работа продвигалась плохо; мои мысли блуждали где-то далеко. Я подвинул мое кресло к камину и задремал. Снова атомы запрыгали перед моими глазами. На этот раз малые группы атомов скромно оставались на заднем плане. Мой мысленный взор, обостренный повторением таких видений, мог теперь различать структуры большого размера в многочисленных пространственных формах; длинные цепи иногда тесно группировались, все они изгибались и поворачивались, подобно змеям. Но что это? Одна из змей ухватила собственный хвост, и эта фигура завертелась перед моими глазами, как бы насмехаясь надо мной. Как от вспышки молнии, я пробудился... Остаток ночи я провел, обдумывая следствие моей гипотезы. Научимся мечтать, и тогда, может быть, мы постигнем истину».
Итак, цикл, кольцо! Но прежде чем окончательно написать формулу бензола, ученому нужно было многое осмыслить. Действительно, как происходит соединение шести атомов углерода в кольцо? Ведь, соединяясь друг с другом, эти атомы были бы трехвалентными. А это противоречило бы теории четырехвалентности углерода, признанной самим А. Кекуле. Ученый приходит к выводу, что оставшиеся валентности углеродных атомов объединяются в три двойные связи, которые чередуются в кольце с одинарными связями. Таким образом, эмпирическая формула С6Н6 превратилась в структурную, которую сейчас называют бензольным кольцом:
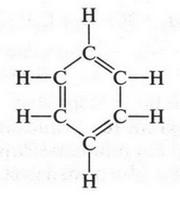
Это выдающееся открытие произошло в 1865 г. Вот так А. Кекуле открыл формулу бензола. Другие химики тоже пытались это сделать, но так и не смогли. Формула А. Кекуле была принята большинством химиков. Интересно, что в 1866 г. эту формулу подтвердили химики в результате одного эксперимента. Оказалось, что бензол можно получить из ацетилена. Три молекулы ацетилена превращаются в одну молекулу бензола. Формально это можно представить так: одна из трех связей в молекуле ацетилена затрачивается на образование простой связи с атомом углерода другой молекулы. Оставшиеся по две связи в трех молекулах бывшего ацетилена сохраняются, образуя шестичленный цикл с чередующимися двойными и простыми связями:
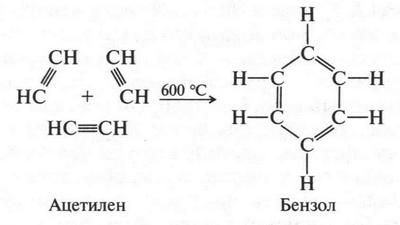
Таким образом, формула бензола, установленная А. Кекуле, наглядно отражает четырехвалентность углеродного атома. Но... опять эта проблема с двойной связью! Мы же убедились, что бензол ни с бромной водой, ни с перманганатом калия не взаимодействует. Можно было бы вообще не обращать внимание на эти связи, считая их присутствие необходимой формальностью, но... Но ведь все гораздо сложнее. Так, было обнаружено, что при определенных условиях к бензолу иногда можно присоединить водород и хлор. В первом случае образуется предельный углеводород — циклогексан, а во втором — гексахлорциклогексан (гексахлоран):
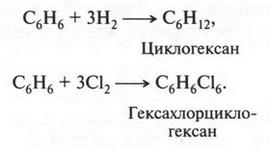
Эти реакции протекают как бы с разрывом двойных связей в молекуле бензола. Правда, таких реакций (с предполагаемым разрывом двойных связей) две, три и не более. Но они есть! Зато других реакций, которые противоречат непредельной формуле бензола, — множество.
Все это привело химиков к единственно правильной мысли: если и присутствуют в молекуле бензола двойные связи, то они какие-то особенные, непохожие на обычные. Действительно, одни ученые утверждают, что они есть, другие — что их нет. Посмотрите на эти две формулы:

(Водородные атомы можно не писать. Это сделано для удобства изображения формулы бензола. Но их обязательно нужно подразумевать.) На первый взгляд эти формулы должны принадлежать разным веществам. В одном из них два углеродных атома, с которыми связаны метальные группы, соединены двойной связью, а во втором соединении — простой. Но оказалось, что двух таких соединений нет, а существует лишь одно — диметилбензол, который называют орто-ксилолом (положения 1,2; 1,3; 1,4 в бензольном кольце обозначают приставками орто-, мета- и пара-). Но опять та же загадка: формально двойная связь вроде бы существует, а на самом деле ее нет. А. Кекуле, понимая этот изъян своей формулы, предложил гипотезу, согласно которой в молекуле бензола должно происходить постоянное чередование двойных и одинарных связей. Другими словами, их место должно постоянно меняться:
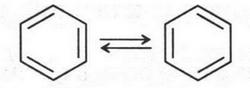
В этом предположении А. Кекуле был на грани разгадки тайн молекулы бензола, но одной даже гениальной интуиции и умелых рук экспериментатора порой бывает недостаточно. Нужны были «умные» приборы, которые помогли бы ученому решить эту загадку. Но для таких приборов время еще не наступило. Поэтому спор о строении загадочного вещества — бензола — длился около 30 лет!
Вот такая история бензола. Что же мы сейчас знаем о строении молекулы этого соединения?
Физические и физико-химические методы исследования многое рассказали нам. Так, мы знаем, что молекула бензола имеет вид плоского правильного шестиугольника, а все шесть углеродных атомов и шесть водородных атомов лежат в одной плоскости, т. е. в плоскости этого шестиугольника. Оказалось, что связи между углеродными атомами равны между собой и длина их составляет 0,140 нм. Обратите внимание на эту величину. Она является средней между длинами одинарной (0,154 нм) и двойной (0,134 нм) связей. Это означает, что в молекуле бензола нет простого чередования простых и двойных связей, а существует особая — «полуторная» связь. Она является промежуточной между простой и двойной связями. Другими словами, в молекуле бензола наблюдается выравнивание одинарных и двойных связей. Вот почему все углеродные атомы в молекуле бензола равноценны и расположены друг от друга на одинаковом расстоянии. Возможно ли все это объяснить с точки зрения теории гибридизации? Давайте попробуем.
Согласно теории гибридизации все углеродные атомы в молекуле бензола находятся в sp2-состоянии. Как известно, при этом углеродный атом образуют три одинаковые sp2-гибридные орбитали. Четвертая же 2p-орбиталь остается негибридизованной, т. е. обычной. Две из трех гибридных орбиталей одного углеродного атома, перекрываясь с такими же орбиталями двух соседних атомов углерода (справа и слева), образуют две о-связи между углеродными атомами. Третья sp2-орбиталь, перекрываясь с 1s-орбиталью атома водорода, образует связь С—Н (рис. 21). Всего в молекуле бензола, как вы видите, 12 ?-связей. Что же происходит с четвертой, негибридизованной 2p-орбиталью?
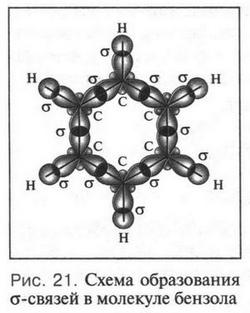
Вот она-то и играет основную роль в проявлении загадочных свойств бензольной молекулы. Эта орбиталь расположена перпендикулярно плоскости бензольного кольца. Всего таких орбиталей шесть — по одной от каждого углеродного атома. Перекрываясь «боками» друг с другом, эти орбитали создают единую ?-электронную систему, общую для всех углеродных атомов бензольного кольца (рис. 22).

Такая система очень похожа на два «бублика», расположенных сверху и снизу кольца. Если такие «бублики» представить в виде вполне съедобных бубликов, то, положив между ними шестиугольник из сыра, получим аппетитный бутерброд, который и будет моделью молекулы бензола. Вот так образуется та особая химическая связь между углеродными атомами в молекуле бензола, которую называют ароматической связью. Все это означает, что молекула бензола — вовсе не циклогексатриен (соединение с тремя строго фиксированными двойными связями), как изображает ее формула А. Кекуле, а система с равномерным распределением ?-электронного облака, т. е. со свободным перемещением ?-электронов по всему шестичленному кольцу. Чтобы приблизиться к более точному изображению структурной формулы молекулы бензола, мы в шестиугольник впишем окружность или пунктирную линию, которые будут нам показывать равномерное распределение ?-электронной плотности.
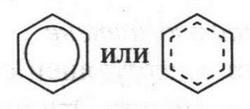
Объемную модель молекулы бензола можно увидеть на рисунке 23.

?-электроны, взаимодействуя друг с другом, придают молекуле бензола особые свойства, которые отличают ее от молекул углеводородов с изолированными двойными связями. Эти свойства бензола и его производных называют ароматичностью.
Особенностью ароматических соединений является легкость замещения водородных атомов кольца на другие атомы или группы атомов. Однако эта «легкость» проявляется прежде всего в том случае, когда бензол взаимодействует с положительно заряженными частицами (катионами). Приведем наиболее известные реакции такого замещения.
Реакции галогенирования (взаимодействие с галогенами). Например, реакция хлорирования начинается с образования хлор-катиона под влиянием катализатора (хлорида железа):
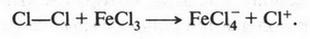
Положительно заряженная частица (хлор-катион) атакует молекулу бензола:
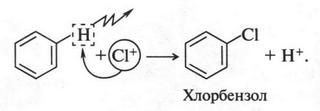
Это, конечно, не уравнение реакции, а только упрощенная схема. В действительности реакция протекает через образование неустойчивых промежуточных соединений. Но в связи со сложностью их строения мы не будем о них говорить. Скажем только, что между атомом углерода бензольного кольца и атомом хлора химическая связь устанавливается за счет пары электронов, которая осталась у углеродного атома после отщепления от него водородного атома в виде протона. Этот протон, взаимодействуя с FeCl-4, снова образует FeCl3 (катализатор):
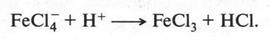
Так образуется хлорбензол.
Реакция нитрования (взаимодействие с азотной кислотой). В этой реакции на бензол действуют «нитрующей смесью» — смесью концентрированных азотной и серной кислот. Эти кислоты образуют не простую смесь, а, взаимодействуя между собой, дают несколько ионов:

Один из этих катионов — ион нитрония NO+2 — атакует молекулу бензола (приводим опять условную схему):
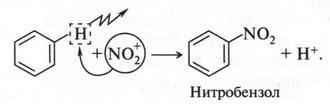
Уходящий протон связывается с анионом HSO-4:
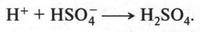
В результате образуется снова серная кислота, которая в этой реакции является катализатором. Вот так получается нитробензол.
Если нитрование проводить при нагревании (100-110 °С), то образуется 1,3,5-тринитробензол — соединение с тремя нитрогруппами в бензольном кольце.
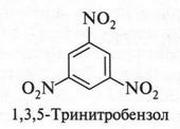
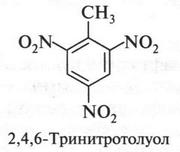
Правда, этот продукт получается с очень низким выходом (иначе его получается мало). Поскольку, как было обнаружено, такой продукт — идеальное бризантное взрывчатое вещество, то во время Второй мировой войны многие химики стали искать более подходящие условия его получения. Однако эти попытки не увенчались успехом. Но тут опять неожиданно открыли, что при нитровании толуола продукта получается больше и он также, как и 1,3,5-тринитробензол, обладает взрывчатым свойством. Этот продукт (2,4,6-тринитротолуол) назвали тротилом, или толом.
Реакция сульфирования (реакция с серной кислотой). Концентрированная серная кислота при нагревании взаимодействует с бензолом, образуя бензолсульфокислоту. При этом на бензол действует сульфониевый ион — S+O3H, который образуется в результате равновесия:
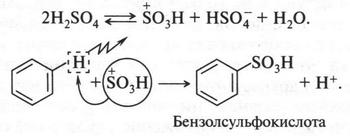
Уходящий протон соединяется затем с бисульфат-ионом, давая снова серную кислоту:

Все эти производные бензола — ценные химические вещества. Как мы увидим в дальнейшем, многие из них нашли широкое применение.
| <<< Назад 4.2. Как стать устойчивой? |
Вперед >>> 4.4. Бензольные кольца вместе и врозь |
- Равенство не означает одинаковость
- 17. Что означает латинское выражение «Mare Liberum»?
- 63. Что означает масштаб карты?
- 380. Что означает нынешняя тенденция к потеплению?
- 41. Что означает часто встречающееся в океанографии выражение «in situ»?
- 18. Откуда возникло выражение «право мирного прохода» и что оно означает?
- Глава 13 Буквой с обозначается скорость света в пустоте
- Откуда появилось и что означает слово «космос»?
- 2.3. Что означает расширение Вселенной?
- Что означает ожог первой, второй и третьей степени?
- ЧЕЛОВЕК АРОМАТНЫЙ
- Ароматный ландшафт
