Книга: Удивительный мир органической химии
4.4. Бензольные кольца вместе и врозь
| <<< Назад 4.3. «Ароматический» не означает «ароматный» |
Вперед >>> 4.5. Циклы с разными атомами |
4.4. Бензольные кольца вместе и врозь
В 1819 г. в каменноугольной смоле было обнаружено бесцветное кристаллическое вещество, которое английский химик Джон Кидд (1780-1851) спустя два года назвал нафталином (от слова нафта — летучая часть нефти). Состав нафталина был установлен в 1858 г. русским химиком Александром Абрамовичем Воскресенским (1809-1880). Эмпирическая формула этого вещества оказалась такой: С10Н8. Для установления его структурной формулы потребовалось еще десять лет. Заслуга в этом принадлежит двум немецким химикам — Э. Эрленмейеру и К. Требе (1841-1927). В результате проведенных исследований оказалось, что молекула нафталина состоит из двух бензольных колец, соединенных вместе:

Сегодня мы знаем о нафталине многое. Так, химики относят его к ароматическим соединениям. Это связано с тем, что его десять 2p-орбиталей, взаимно перекрываясь друг с другом, образуют единое ?-электронное облако (кстати, две 2p-орбитали являются общими для двух колец). Однако рентгеноструктурный анализ, проведенный в 1951 г., показал, что в молекуле нафталина (в противоположность бензолу) углерод-углеродные связи несколько различаются между собой по длине. Поэтому ?-электронная плотность в его молекуле менее выравнена, чем в молекуле бензола. Все это сказалось и на химических свойствах нафталина. Нафталин может вступать не только в реакции замещения, как бензол, но и в реакции присоединения. Есть еще одна особенность нафталина, которая отличает его от бензола: его водородные атомы немного отличаются друг от друга. Это проявляется в том, что одни из них сравнительно легко замещаются на другие атомы или группы атомов, а другие — труднее. Так, при галогенировании, нитровании и сульфировании заместитель становится прежде всего в положение 1 (или то же самое 4, 5, 8):
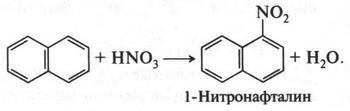
Менее равномерное распределение ?-электронной плотности делает нафталин более «непредельным» (менее ароматичным), чем бензол. Поэтому он вступает также и в реакции присоединения и окисления. Например, при восстановлении нафталина (присоединение атомов водорода) образуются два продукта — тетралин и декалин.

Эти продукты используют в качестве растворителей жиров.
При окислении нафталина образуется фталевый ангидрид.
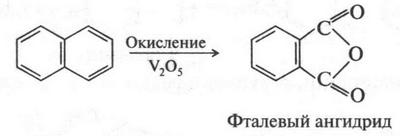
Его применяют для получения полимеров, красителей и лекарственных препаратов.
Еще совсем недавно нафталин в быту использовали в качестве средства против моли. Нафталиновый запах в платяном шкафу хорошо знаком людям старшего поколения. Одежду и особенно меховые изделия обрабатывали нафталином (нафталин легко испаряется, и его пары отпугивают моль, но не уничтожают). Однако, как установили, нафталин не такой уж безобидный препарат и для человека. Поэтому использование нафталина с этой целью было запрещено в нашей стране еще в 1988 г. Вместо нафталина сейчас используют более безопасные для человека средства.
Если к молекуле нафталина «приклеить» еще одно бензольное кольцо, то получим другое соединение — антрацен.

Антрацен (от греч. антракс — уголь) был обнаружен в 1857 г. в продуктах перегонки каменноугольной смолы русским химиком Юлием Федоровичем Фрицше (1808-1871). Он же определил и его состав, который отвечал эмпирической формуле С14Н10.
Антрацен обладает ароматическими свойствами, однако они выражены еще в меньшей степени, чем у нафталина (а тем более у бензола). Это связано, как и в случае нафталина, с неодинаковыми длинами углерод-углеродных связей в молекуле. Поэтому антрацен может вступать не только в реакции замещения, но и присоединения и окисления. В этих реакциях наиболее активными водородными атомами являются те, которые связаны с углеродными атомами 9 и 10. Именно туда направляются заместители при реакциях замещения. Например:
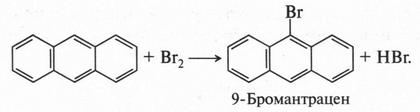
Антрацен, как и нафталин, вступает в реакции восстановления.
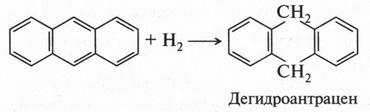
При окислении антрацена образуется соединение с двумя карбонильными группами — антрахинон.
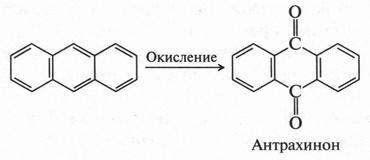
Антрахинон — основа многочисленных органических красителей, которые так и называются — антрахиноновые. Самым первым и давно известным таким красителем был знаменитый ализарин.
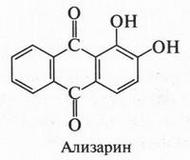
Этот краситель в древности выделяли из корней марены, которую для этих целей выращивали на побережье Средиземного моря. Даже трудно представить, сколько нужно было переработать этих растений, чтобы получить несколько граммов красителя! Естественно, что его цена была очень высокой и он не мог широко использоваться для промышленных целей. Вот если бы удалось получить ализарин синтетическим путем! Но в то время это было еще мечтой. И только в 1868 г. немецкие химики К. Гребе и К. Либерман (1842-1914) сообщили о том, что они знают, как устроен этот краситель, и даже получили его в лаборатории. Об этом заявил К. Гребе на заседании Химического общества в начале 1869 г., а уже через два года синтетический краситель поступил в продажу. Он был чище и качественнее природного, но, главное, — намного дешевле. В настоящее время этот краситель используется мало. Зато широко применяются другие производные антрахинона, которые более качественно окрашивают ткани в многочисленные цвета. Но об этом мы расскажем в другом разделе этой книги.
Итак, существуют соединения с двумя и тремя бензольными кольцами. Однако химикам знакомы еще более сложные ароматические углеводороды. Например, некоторые высококипящие фракции каменноугольной смолы содержат ароматические углеводороды, молекулы которых состоят из четырех, пяти, шести и более бензольных колец. Такие соединения сокращенно называют полициклическими ароматическими углеводородами (ПАУ). Вот некоторые из них:
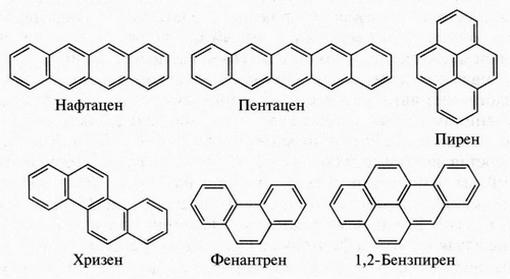
Известны и другие ПАУ. Многие из них образуются в качестве побочных продуктов при термической переработке органических веществ, а также при сжигании различного топлива (газа, нефти, угля, дров и т. д.). С одной стороны, ПАУ — многообещающие источники самых разнообразных органических соединений, а с другой — могут таить в себе грозную опасность. Еще в 1914 г. японские химики обнаружили, что если к коже подопытных животных на продолжительное время приложить некоторые ПАУ, то можно вызвать злокачественные опухоли. Такие вещества стали называть канцерогенами (от лат. cancer — рак). К таким соединениям относят в первую очередь 1,2-бензпирен — углеводород, молекула которого состоит из пяти сконденсированных бензольных колец. Это один из самых опасных канцерогенов, которые мы знаем.
1,2-бензпирен был выделен из каменноугольной смолы в 1963 г., а несколько позже был обнаружен в табачном дыме. Известно, что существует прямая связь между курением и раком легких у курильщиков. Это заболевание в последнее время особенно распространено в связи с увеличением числа людей, особенно молодых, попавших в зависимость от папиросы...
Много разнообразных ПАУ встречается в саже и копоти, оседающих в дымоходах, коптильных камерах (рыбокоптильные и колбасные предприятия), выхлопных трубах автомобилей и мотоциклов. Особую осторожность нужно соблюдать при работе с сажей, которую в огромных количествах используют в качестве наполнителей (производство автомобильных покрышек и некоторых пластмасс). ПАУ встречаются везде, где имеют дело с дымом. Таят в себе опасность всевозможные костры, в которых сгорают мусор, осенние листья, старая трава, изделия из резины и пластмассы, старые кино- и фотопленки и т. д. Огромный урон здоровью наносят постоянно тлеющие городские свалки. Даже небольшой костер на опушке леса, на берегу реки, который так любят разводить туристы и отдыхающие, является источником ПАУ. Расположившись около него, люди дышат опасным дымом. Но самую большую опасность для человека представляет автомобиль с его выхлопными газами, которые являются источником всевозможных ПАУ, в том числе и 1,2-бензпирена. Вдумайтесь в такой факт: общий мировой выброс 1,2-бензпирена в атмосферу составляет более 5000 т в год... Даже в продуктах сгорания метана, который вы используете в газовой плите на кухне, обнаружены очень высокие концентрации этого страшного вещества (до 18 мг на 1 м3 сгоревшего газа!). Вот почему важно, чтобы метан сгорал в плите полностью, не давая копоть, а форточка в кухне была всегда открытой.
Мы познакомились с органическими соединениями, в молекулах которых бензольные кольца имеют общую грань (т. е. два и более углеродных атомов являются общими для колец). Такие соединения называются, как известно, конденсированными. Если же бензольные кольца связаны друг с другом обычной ковалентной связью, то это уже другие соединения — неконденсированные. Рассмотрим некоторые из них.
Самое простое соединение этого типа — дифенил.
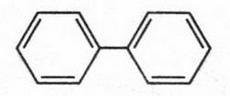
Дифенил получают пиролизом бензола (750-800 °С). В органической химии хорошо известны его многочисленные производные.
Если в молекуле дифенила бензольные кольца разделить одной группой СН2, то получим другое вещество — дифенилметан.
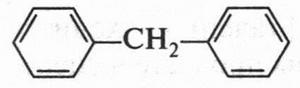
В его молекуле два бензольных кольца соединены с одним углеродным атомом. Если с этим атомом связать три бензольных кольца, то получим трифенилметан, молекула которого напоминает трехлопастный пропеллер.
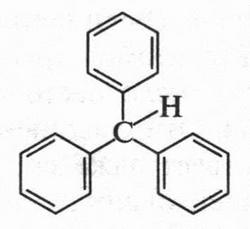
Бензольные кольца в такой молекуле не находятся в одной плоскости, а несколько развернуты относительно друг друга. Иначе водородные атомы в ортоположениях бензольных колец будут мешать друг другу.
Трифенилметан является основой многочисленных красителей, которые называются трифенилметановыми. Перед вами формула одного из них.
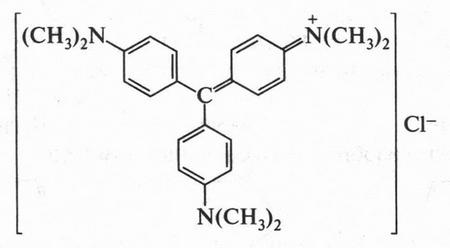
Это — кристаллический фиолетовый. Молекула красителя состоит из двух частей — большого катиона и маленького аниона. Следовательно, этот краситель представляет собой соль. В катионе вы без труда узнаете структуру трифенилметана, который является основой этого красителя.
А вот еще пример. Каждому школьнику известен индикатор на щелочь фенолфталеин.
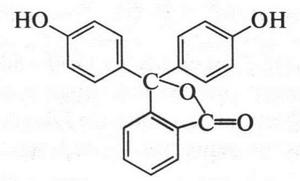
В основе молекулы фенолфталеина находится также трифенилметан. Об этих и других красителях вы прочтете в специальном разделе.
| <<< Назад 4.3. «Ароматический» не означает «ароматный» |
Вперед >>> 4.5. Циклы с разными атомами |
