Книга: Удивительный мир органической химии
2.2. «Жилище» для электронов — орбиталь
| <<< Назад 2.1. В глубь углеродного атома |
Вперед >>> 2.3. Гибрид из орбиталей |
2.2. «Жилище» для электронов — орбиталь
Электрон нельзя сравнить ни с чем, что окружает нас в этом мире. Сколько бы ни было электронов в атоме, ни один из них не повторяет по свойствам другой. Каждый электрон индивидуален. Но у них есть и сходные свойства. Главное из них — все электроны находятся в постоянном движении. Если бы электрон был неподвижен, он тотчас бы упал на ядро, так как противоположные заряды, которые несут электрон и ядро, взаимно притягиваются. Однако электроны не вращаются вокруг ядра, как Земля вокруг Солнца, поэтому плоских электронных орбит в атоме не существует. Движение в атоме очень сложное и подчиняется особым законам (законам квантовой механики). Но самое удивительное то, что электрон совмещает в себе, казалось бы, несовместимое. С одной стороны, электрон обладает свойствами частицы (с массой 9,109 • 10-31 кг), а с другой — свойствами волны (с длиной около 10-10 м). Так, попадая на пластинку с фотослоем, электрон вызывает почернение в одном определенном месте ее поверхности (в одном «зерне» фотослоя). Это — доказательство того, что электрон является частицей. В то же время электроны способны огибать встречающиеся на пути преграды и препятствия. Но это же свойство характерно и для волн! Один ученый-физик пошутил по этому поводу: «По понедельникам, средам и пятницам электрон ведет себя как волна, а по вторникам, четвергам и субботам — как частица, в воскресенье же он отдыхает...»
Двойственная природа («частица-волна») электрона приводит к тому, что для него не существует такого понятия, как траектория его движения. Нельзя одновременно установить, где находится электрон в данный момент и в каком направлении он движется. Другими словами, электрон «мечется» не по какой-то определенной траектории, а, «прыгая» с колоссальной скоростью, может находиться в любой части околоядерного пространства — то ближе, то дальше от ядра. В этом случае можно говорить только о возможности (вероятности) пребывания электрона в том или другом положении относительно ядра атома. Электрон как бы «размазан» в этом пространстве, и все его траектории движения сливаются в сплошное облако (рис. 4). При этом плотность такого облака убывает с увеличением расстояния от ядра. Если изобразить вероятность нахождения электрона в какой-то момент на определенном расстоянии от ядра в виде точек, то получим такую картину: где-то таких точек будет мало и там электрон будет довольно редко, а где-то этих точек будет очень много и электрон там находится чаще. Такое околоядерное пространство, в котором электрон находится большее время, называется электронным облаком или электронной орбиталью.
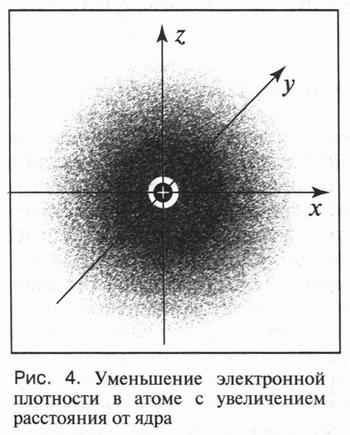
Таким образом, об электроне, который движется в данной области пространства, принято говорить, что он «находится на этой орбитали». При этом понятия «орбиталь» и «орбита» нельзя путать. Это — разные понятия.
Орбитали различаются формами, объемом и пространственным расположением. Установлено, что на одной орбитали может находиться не более двух электронов. Эти электроны, кроме движения вблизи ядра, еще вращаются вокруг собственной оси. Такое вращение называется спином (от англ. spindle — веретено). При этом один электрон вращается в одну сторону, а второй — в другую. Такие спины называются противоположными. Их изображают в виде двух противоположно направленных стрелок, размещенных в квадрате (квадрат — условное обозначение орбитали):
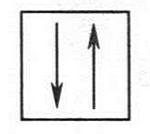
Электроны с противоположными спинами называют спаренными или неподеленной электронной парой.
Если атом углерода не образует связей с другими атомами, то его называют «невозбужденным». В таком атоме электроны располагаются следующим образом: на первом энергетическом уровне (К), который является в то же время 1s-подуровнем, находятся два электрона (1s2). На втором уровне (L), состоящем из двух подуровней — нижнего (2s) и более высокого (2p), располагаются соответственно два (2s2) и два (2p2) электрона (всего четыре). Электроны, находящиеся на 1s- или 2s-подуровнях, называются s-электронами, а на 2p-подуровнях — р-электронами.
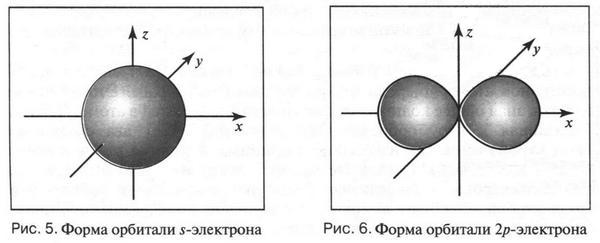
Орбитали, образованные s-электронами, имеют форму шара (рис. 5), а орбитали 2p-электронов можно изобразить в виде объемной «восьмерки» или «гантели» (рис. 6).
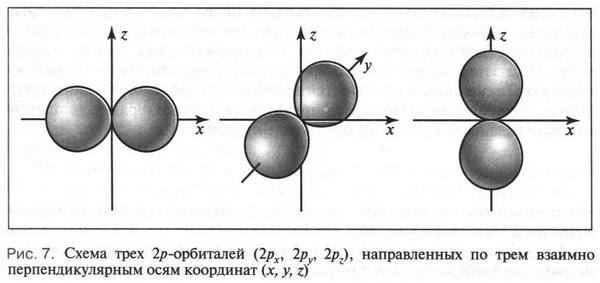
Если орбиталь сферической формы имеет только одно расположение относительно осей координат, то гантелеобразные 2p-орбитали располагаются взаимно перпендикулярно друг к другу по осям х, у, z. Это и понятно: в этом случае наблюдается наименьшее отталкивание электронов друг от друга. Чтобы как-то отличать 2p-орбитали, их обозначают соответственно 2рх, 2ру, 2pz (рис. 7). Таким образом, каждая орбиталь в атоме имеет определенную форму и особое расположение в пространстве.
Находясь на разных уровнях и подуровнях, электроны обладают различной энергией. Так, 1s-электроны имеют меньшую энергию, чем 2s-электроны, а эти, в свою очередь, менее богаты энергией, чем 2p-электроны.
| <<< Назад 2.1. В глубь углеродного атома |
Вперед >>> 2.3. Гибрид из орбиталей |
- 29. Орбитальное квантовое число. Формы электронных облаков.
- 6.5. Российские информационные системы для работы с орбитальными и физическими характеристиками малых тел Солнечной сист...
- 4.4. Орбитальные параметры комет
- Орбитальная навигация сверхразвитых цивилизаций
- Орбитальная механика
- Орбитальные резонансы
- ОТКРЫТИЕ ЭЛЕКТРОНОВ И КВАРКОВ
- Квантовое туннелирование электронов в биологии
- 1.10.2. Орбитальные смещения
- Служба вторичных электронов
- Глава пятая. Служба свободных электронов
- 2.7. Орбитальные станции: «Салют», «Космос», «Мир», «МКС»
